
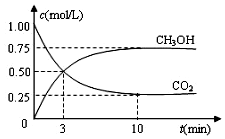
 目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.分析 (1)从反应开始到平衡,图象中甲醇浓度变化为0.75mol/L,结合化学方程式定量关系计算消耗氢气的浓度,平衡浓度=起始浓度-平衡浓度;
(2)平衡常数随温度变化不随浓度等因素影响;
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(4)将容器的容积压缩到原来的$\frac{1}{2}$,压强增大,反应速率增大,平衡向正反应方向移动,以此判断;
(5)结合化学平衡三行计算列式计算平衡浓度,平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;若开始时向该1L密闭容器中充入1mol CO2,2mol H2,1.5mol CH3OH和1mol H2O(g),计算此时浓度商和平衡常数比较判断反应进行的方向.
解答 解:(1)起始氢气浓度c=$\frac{3mol}{1L}$=3mol/L,图象得到甲醇浓度变化为0.75mol/L,化学方程式计算,CO2(g)+3H2(g)?CH3OH(g)+H2O(g),氢气消耗浓度0.75mol/L×3=2.25mol/L,则平衡浓度=3mol/L-2.25mol/L=0.75mol•L-1,
故答案为:0.75mol•L-1;
(2)若改变条件使平衡向正反应方向移动,若是浓度变化,平衡常数不变,若是温度变化,降低温度平衡正向进行,平衡常数增大,故平衡常数可能增大,故选ac,
故答案为:ac;
(3)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,反应为气体体积减小的放热反应,
A.反应前后气体物质的量变化,恒温、恒容时,容器内的压强不再变化说明反应达到平衡状态,故A正确;
B.反应前后气体质量和气体物质的量不变,恒温、恒容时,容器内混合气体的密度始终不变化,不能说明反应达到平衡状态,故B错误;
C.一定条件下,CO2、H2和CH3OH的浓度保持不变是平衡标志,故C正确;
D.一定条件下,单位时间内消耗3mol H2的同时生成1mol CH3OH只能说明反应正向进行,不能说明反应达到平衡状态,故D错误;
故答案为:AC;
(4)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,反应为气体体积减小的放热反应,在其他条件不变的情况下,将体系体积压缩到原来的$\frac{1}{2}$,物质浓度增大,平衡正向进行,
a.体积缩小浓度增大,氢气的浓度增大,故a错误;
b.体积缩小压强增大,正反应速率增大,逆反应速率也增大,故b正确;
c.将体系体积压缩到原来的$\frac{1}{2}$,物质浓度增大,平衡正向进行,甲醇的物质的量增加,故c正确;
d.将体系体积压缩到原来的$\frac{1}{2}$,物质浓度增大,平衡正向进行,重新平衡时n(H2)/n(CH3OH)减小,故d错误;
故答案为:bc;
(5)现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.75 2.25 0.75 0.75
平衡量(mol/L) 0.25 0.75 0.75 0.75
K=$\frac{0.75×0.75}{0.25×0.7{5}^{3}}$=$\frac{16}{3}$,
若开始时向该1L密闭容器中充入1mol CO2,2mol H2,1.5mol CH3OH和1mol H2O(g),Qc=$\frac{1×1.5}{1×{2}^{3}}$=$\frac{3}{16}$<K=$\frac{16}{3}$,反应正向进行,
故答案为:$\frac{16}{3}$; 正.
点评 本题考查化学反应速率、化学平衡的计算及影响因素、盖斯定律的应用、平衡常数计算等,掌握化学平衡移动原理和化学平衡的计算是解题关键,题目难度中等.


科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
在含有酚酞的0.1 mol / L氨水中加入少量的 NH4Cl晶体,则溶液颜色( )
A.变蓝色 B.变深 C.变浅 D.不变
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙苯催化脱氢生产苯乙烯的反应:
乙苯催化脱氢生产苯乙烯的反应: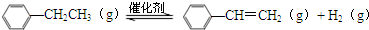
化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| 总压强/100kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| n(HI)/mol | 1.80 | 1.64 | 1.52 | 1.44 | 1.40 | 1.40 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5mol/L | B. | 2.0mol/L | C. | 1mol/L | D. | 2.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此反应在任何温度下都能自发进行 | |
| B. | 此反应仅在低温下自发进行 | |
| C. | 此反应仅在高温下自发进行 | |
| D. | 此反应在任何温度下都不能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有①②④有尽有 | C. | 只有①②③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com