
以下一些氧化物和单质之间可发生如图所示的反应:
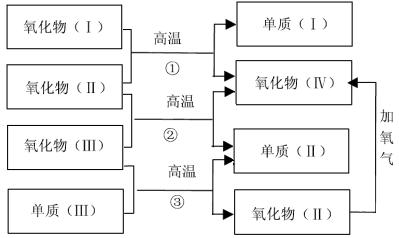
其中,氧化物(Ⅰ)是红棕色固体、氧化物(Ⅱ)、(Ⅲ)、(Ⅳ)在反应条件下都是气体。
(1)氧化物(Ⅰ)的化学式(分子式)是 。
氧化物(Ⅱ)的化学式(分子式)是 。
(2)反应①的化学方程式是
。
反应②的化学方程式是 。
反应③的化学方程式是 。
科目:高中化学 来源: 题型:
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl====2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4====2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是_____________________。
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子( )。2001年我国卫生部规定,饮用水中
)。2001年我国卫生部规定,饮用水中 的含量应不超过0.2 mg·L-1。
的含量应不超过0.2 mg·L-1。
饮用水中ClO2、 的含量可用连续碘量法进行测定。ClO2被I-还原为
的含量可用连续碘量法进行测定。ClO2被I-还原为 、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2.0时,
、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2.0时, 也能被I-完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:
也能被I-完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:

2Na2S2O3+I2====Na2S4O6+2NaI
①请写出pH≤2.0时, 与I-反应的离子方程式__________________________。
与I-反应的离子方程式__________________________。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加 入到锥形瓶中。
入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加少量淀粉溶液,用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1 mL。
步骤5:_________________________________。
步骤6:再用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
③根据上述分析数据,测得该饮用水样中 的浓度为________________mol·L-1 (用含字母的代数式表示)。
的浓度为________________mol·L-1 (用含字母的代数式表示)。
④若饮用水中 的含量超标,可向其中加入适量的Fe2+将
的含量超标,可向其中加入适量的Fe2+将 还原成Cl-,该反应的氧化产物是____________________________(填化学式)。
还原成Cl-,该反应的氧化产物是____________________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):

已知:a.常见双原子单质分子中,X分子含共价键最多。
b.甲分子含10个电子,乙分子含18个电子。
(1)X的电子式是______________________________。
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。

①在图中方框内绘出用烧瓶收集甲的仪器装置简图。
②试管中的试剂是(填写化学式)________________________________________。
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)
______________________________________________________________________。
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电
子结构,丁的化学式是____________________。
(4)n mol丁与n mol丙在一定条件下反应,生成4n mol乙和另一化合物,该化合物蒸气的密度是相同状况下氢气的174倍,其化学式是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源。
(1)硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为 。
(2)用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫,其电解总反应方程式(忽略氧的氧化还原)为 ;该方法的优点是 。
(3)一定温度下1 mol NH4 HS固体在定容真空容器中可部分分解为硫化氢和氨气。
①当反应达平衡时ρ氨气×p硫化氢=a(Pa2),则容器中的总压为 Pa;
②下图是上述反应过程中生成物浓度随时间变化的示意图。若t2时增大氨气的浓度且在t3时反应再次达到平 衡,请在图上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线.
衡,请在图上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线.

查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,向100 mL氢硫酸溶液中通人二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为
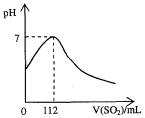
A.0.5 mol/L B.0.05 mol/L
C.1 mol/L D.0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组进行与NH3有关的系列实验。
⑴从下图中挑选所需仪器,画出制取干燥NH3的装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置和尾气处理装置不用画),并标明所用试剂。
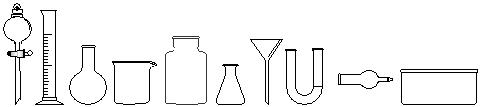
⑵将NH3通入溴水中,有N2生成,反应的化学方程式为 。
⑶为验证“同温同压下,相同体积的任何气体都含有相同数目的分子”,该小组同学设计了如图所示的装置,图中B管的容积是A管的2倍,活塞K1、K2、K3、K4、K5均(固定装置和尾气处理装置略;HCl和NH3均不溶于石蜡油,也不与之反应;装置气密性好)。
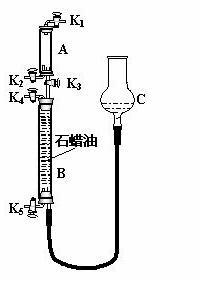
①在A管中充满与大气压强相等的干燥HCl气体。操作是 。
控制活塞K4、K5,调节C,使B管充满与A管同压的干燥NH3。
②缓缓开启K3,A管中的现象是 。要达到实验目的,当反应完成并恢复到室温时,B管中预期的现象是 ;若观察不到预期现象,主要原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z都是短周期的元素,它们的原子序数依次递增。X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层的三倍,Y和Z可以形成两种以上气态化合物,则
(1)X是 ,Y是 ,Z是  。
。
(2)由Y和Z组成,且Y和Z的质量比为7:20的化合物的化学式(分子式)是 。
(3)由X、Y、Z中的两种元素组成,且与X2Z分 子具有相同电子数的两种离子是 和 。
子具有相同电子数的两种离子是 和 。
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4:2:3,该盐的化学式(分子式)是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
用特殊方法把固体物质加工到纳米级(1nm﹣100nm)的超细粉末粒子,然后制得纳米材料.下列分散系中的分散质的粒子的大小和这种纳米粒子大小具有相同的数量级的是( )
|
| A. | 溶液 | B. | 悬浊液 | C. | 胶体 | D. | 乳浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关高分子材料的表述不正确的是( )
|
| A. | 合成高分子材料都很难降解 |
|
| B. | 塑料、合成纤维、黏合剂、涂料等都是合成高分子材料 |
|
| C. | 棉花、羊毛、天然橡胶等属于天然高分子材料 |
|
| D. | 线型和体型高分子材料在溶解性、热塑性和热固性等方面有较大的区别 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com