
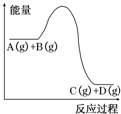
| A. | 加入催化剂时,该反应的反应热发生改变 | |
| B. | 升高温度,利于A的转化率增大 | |
| C. | 该反应的正反应为放热反应 | |
| D. | 增大压强,能够加快反应达到平衡状态的速率 |
分析 A.催化剂不改变反应热;
B.升高温度,平衡向吸热方向进行;
C.根据反应物与生成物总能量大小判断;
D.增大压强,正逆反应速率都加快,缩短反应达到平衡状态的时间.
解答 解:A.反应体系中加入催化剂,只改变活化能,不能改变反应热,故A错误;
B.正反应放热,则升高温度,平衡向逆方向移动,A的转化率减小,故B错误;
C.由图象可知,反应物总能量大于生成物总能量,反应放热,故C正确;
D.增大压强,正逆反应速率都加快,缩短反应达到平衡状态的时间,所以增大压强,能够加快反应达到平衡状态的速率,故D正确;
故选CD.
点评 本题考查较为综合,涉及反应热与焓、化学平衡的影响因素等,为高考常见题型,侧重于考查学生化学知识的综合应用能力,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 ;
; ,其核磁共振氢谱中有2个吸收峰.
,其核磁共振氢谱中有2个吸收峰.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用“绿色化学”工艺,使原料完全转化为目标产物 | |
| B. | 推广燃煤脱硫技术,减少SO2污染 | |
| C. | 推广垃圾的分类存放、回收、处理 | |
| D. | 大量使用农药化肥以提高粮食产量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如图所示电解实验可制得白色纯净的Fe(OH)2沉淀.两电极的材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如图所示电解实验可制得白色纯净的Fe(OH)2沉淀.两电极的材料分别为石墨和铁.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验操作 | 现象 |
① | 向大试管中加入20mL 0.1mol?L-1的Na2S溶液 (已知Na2S溶液显碱性,pH约为12),再滴加5mL 0.1mol?L-1的FeCl3溶液,边滴边振荡 | 产生大量黑色沉淀,反应后溶液仍显碱性 |
② | 向另一支大试管中加入20mL 0.1mol?L-1FeCl3溶液(已知FeCl3溶液显酸性,pH约为2),再滴加5mL 0.1mol?L-1的Na2S溶液,边滴边振荡 | 局部有黑色沉淀但瞬间消失,溶液颜色变浅,并产生大量黄色浑浊,反应后溶液仍显酸性 |
| 实验操作 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+ (Al3+),加过量的氨水,过滤 | |
| B. | KCl溶液(BaCl2),加入足量的K2SO4溶液,过滤 | |
| C. | CO2 (SO2),将混合气体通过依次饱和碳酸氢钠溶液和浓硫酸,洗气 | |
| D. | NaHCO3溶液(Na2CO3溶液):加入适量的Ca(OH)2溶液,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com