
| A. | Cl2+FeI2═FeCl2+I2 | |
| B. | 2Fe3++2I-═2Fe2++I2 | |
| C. | 2KMnO4+16HCl═2MnCl2+5Cl2↑+2KCl+8H2O | |
| D. | 2FeCl3+4FeI3═3Cl2+6FeI2 |
分析 根据氧化还原反应的强弱规律,氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物;在酸性溶液中还原性强弱的顺序是SO2>I->H2O2>Fe2+>Cl-,在溶液中进行的反应只能前面的粒子还原后面的,否则反应不能发生,据此对各选项进行解答.
解答 解:A、反应中氧化剂Cl2的氧化性大于氧化产物Fe3+,和题干顺序相符,所以反应能发生,故A错误;
B、反应中氧化剂Fe3+的氧化性大于氧化产物I2,和题干顺序相符,所以反应能发生,故B错误;
C、反应中氧化剂KMnO4的氧化性大于氧化产物Cl2,和题干顺序相符,所以反应能发生,故C错误;
D、反应中氧化剂Fe3+,的氧化性大于氧化产物Cl2,和题干顺序不相符,所以反应不能发生,故D正确.
故选D.
点评 本题考查了氧化还原反应的强弱规律的应用,题目难度中等,注意掌握氧化还原反应的特征及氧化性、还原性强弱大小的判断方法,明确溶液中进行的反应,必须满足:氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液,有气体生成,溶液未呈血红色,说明稀硝酸不能将Fe氧化为Fe3+ | |
| B. | 除去FeCl3溶液中少量Cu2+:向含有少量Cu2+的FeCl3溶液中加入适量铁粉,充分反应后过滤 | |
| C. | 比较Fe(OH)3和Al(OH)3的Ksp:向0.1mol•L-1的FeCl3溶液中滴加0.1mol•L-1氨水至不再产生沉淀,然后再滴入0.1mol•L-1A1Cl3溶液,观察现象 | |
| D. | 验证氧化性Fe3+<Br2<Cl2;向试管中依次加入1mL0.1mol•L-1FeBr2溶液、几滴KSCN溶液和1mL苯,然后逐滴加入氯水,并缓缓振荡,直到氯水过量,观察整个过程中有机层和水层中的现象. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H | B. | Cl | C. | Na | D. | K |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
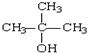
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制90mL1.00mol/L的NaCl溶液,用托盘天平称取5.3gNaCl固体 | |
| B. | 用蒸发方法使NaCl从溶液中析出时,应当坩埚中有大量固体析出时移走酒精灯用余热蒸干 | |
| C. | 先在天平两个托盘上各放一张相同质量的滤纸,再把氢氧化钠固体放在滤纸上称量 | |
| D. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验操作 | 实验现象 | |
| Ⅰ | 打开活塞c,将过量稀HNO3加入装置B中,关闭活塞c | B中浅绿色溶液最终变为黄色. |
| Ⅱ | 用注射器取出少量B装置中的溶液,加入KSCN溶液 | 溶液变为红色. |
| Ⅲ | 打开活塞b,向A装置中加入足量硫酸,关闭活塞b | A中产生气体;B中有气泡,液面上有少量红棕色气体生成. |
| Ⅳ | 一段时间后,用注射器取出少量B装置中的溶液,… | … |
| Ⅴ | 打开活塞a,通入一段时间空气 | ---- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容 器 编 号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
| A. | 三个容器内反应的平衡常数③>①>② | B. | 放出热量a<b<92.4 | ||
| C. | N2的转化率①<② | D. | 达平衡时氨气的体积分数①>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com