
分析 某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,则C为O元素、D为S元素;E元素的外围电子排布为(n-l)dn+6nsl,则n+6=10,故n=4,故其外围电子排布为3d104sl,则E为Cu;故该深蓝色晶体应含有[Cu(NH3)4]2+、SO42-,结合原子序数可知A为H、B为N,由原子数目之比,可知该配合物含有1个结晶水,故其化学式为:[Cu(NH3)4]SO4•H2O,据此进行解答.
解答 解:某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,则C为O元素、D为S元素;E元素的外围电子排布为(n-l)dn+6nsl,则n+6=10,故n=4,故其外围电子排布为3d104sl,则E为Cu;故该深蓝色晶体应含有[Cu(NH3)4]2+、SO42-,结合原子序数可知A为H、B为N,由原子数目之比,可知该配合物含有1个结晶水,故其化学式为:[Cu(NH3)4]SO4•H2O,
(1)D为S元素,其原子序数为16,处于周期表中第三周期ⅥA族,
故答案为:第三周期ⅥA族;
(2)由上述分析可知,该配位化合物的化学式为:[Cu(NH3)4]SO4•H2O,
故答案为:[Cu(NH3)4]SO4•H2O;
(3)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,分别为H2O与H2O2,由于H2O与H2O2之间形成氢键,两种化合物可任意比互溶,
故答案为:H2O与H2O2之间形成氢键;
(4)A元素与B元素可形成分子式为H2N2的化合物,该化合物的分子具有平面结构,应存在N=N双键,则其结构式为:H-N=N-H,
故答案为:H-N=N-H;
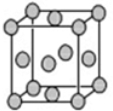
(5)根据晶胞结构可知,该晶胞为面心立方结构,所以铜原子的配位数为12;CuSO4常作电镀液,其中SO42-中S原子价层电子对数=4+$\frac{6+2-2×4}{2}$=4,S原子不含孤对电子,故其为正四面体构型,S原子采取sp3杂化,
故答案为:12;正四面体;sp3杂化.
点评 本题是对物质结构与性质的考查,题目难度中等,试题涉及元素化合物推断、氢键、结构式、微粒构型判断、杂化轨道、晶胞计算等知识点,解答关键是根据配位化合物为深蓝色晶体进行推断,试题培养了学生的分析、理解能力.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,11.2 L己烷含有分子数为0.5NA | |
| B. | 4.2 g乙烯和环丙烷的混合气体含有H原子数为0.6NA | |
| C. | 甲基(-CH3)的电子总数为10NA | |
| D. | 在常温常压下,2.24 L丁烷和2-甲基丙烷的混合气体所含分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | 硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 |
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:选择题
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g) 2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验溶液中是否含有SO32-时,用硝酸酸化后再加BaCl2溶液 | |
| B. | 为增强高锰酸钾的氧化能力,向高锰酸钾溶液中加入稀硝酸酸化 | |
| C. | 检验溶液中是否含有Fe2+时,用硝酸酸化后,加KSCN溶液 | |
| D. | 检验溶液中是否含有SO42-时,用盐酸酸化后,加BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源:2017届河南省南阳市高三上学期第三次月考化学试卷(解析版) 题型:选择题
从某些反应看,NH3和H2O、NH4+和H3O+、NH2—和OH-、N3-和O2-两两类似。据此判断下列反应正确的是
①CaO+2NH4Cl===CaCl2+2NH3↑+H2O②2Na+2NH3===2NaNH2+H2↑
③3Mg(NH2)2===Mg3N2+4NH3↑④NH4Cl+NaNH2===NaCl+2NH3↑
A.只有③
B.只有①
C.①和②
D.都正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com