
| 弱酸 | HA | HB | H2C |
| 电离平衡常数 (25℃) | K=1.77×10-4 | K=4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A、2Bˉ+H2C=2HB+C2- |
| B、2HA+C2-=2Aˉ+H2C |
| C、中和等体积、等pH的HA和HB消耗NaOH的量前者小于后者 |
| D、等体积、等浓度的NaA和NaB溶液中所含离子总数前者大于后者 |


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
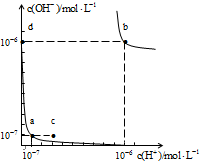
| A、图中对应点的温度关系为:a>b |
| B、水的离子积常数Kw数值大小关系为:b>d |
| C、温度不变,加入少量NaOH可使溶液从a点变到c点 |
| D、在b点对应的温度下,pH=6的溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有自发进行的化学反应都是放热反应 |
| B、熵减小的化学反应不能自发进行 |
| C、气体分子总数增多的反应是熵增大的反应 |
| D、同一物质的固、液、气三种状态的熵值相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、温度T1℃比 T2℃高 |
| B、正反应为放热反应 |
| C、甲图纵轴可以表示A的转化率 |
| D、甲图纵轴可以表示混合气体平均相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有② | B、只有③ |
| C、只有②④ | D、①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com