
已知: 时,
时, 的
的 。下列判断正确的是
。下列判断正确的是
A.  时,饱和
时,饱和 溶液与饱和
溶液与饱和 溶液相比,前者的
溶液相比,前者的 大
大
B.  时,在
时,在 的悬浊液中加入少量的
的悬浊液中加入少量的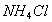 固体,
固体,  增大
增大
C.  时,
时, 固体在20mL0.01
固体在20mL0.01 氨水中的
氨水中的 比在20mL0,01
比在20mL0,01
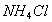 溶液中的
溶液中的 小,
小,
D.  时,在
时,在 的悬浊液中加入
的悬浊液中加入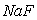 溶液后
溶液后 不可能转化为
不可能转化为
科目:高中化学 来源: 题型:
(1)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为KOH溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:
。
 (2)如图为钠高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS====Na2Sx,正极的电极反应式为 。
(2)如图为钠高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS====Na2Sx,正极的电极反应式为 。
M(由Na2O和Al2O3制得)的两个作用是 。
与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的 倍。
(3)以甲醇为燃料的电池中,电解质溶液为酸性,负极的反应式为 ,正极的反应式为 。理想状态下,该燃料电池消耗1 mol甲醇所能产生的最大电能为702.1 kJ,则该燃料电池的理论效率为 (燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比,甲醇的燃烧热为ΔH=-726.5 kJ·mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
尿素是蛋白质代谢的产物,也是重要的化学肥料。工业合成尿素反应如下:
2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
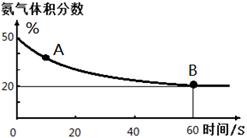 (1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示。
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示。
A点的正反应速率v正(CO2)_______B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);
氨气的平衡转化率为________________________。
(2)氨基甲酸铵是合成尿素的一种中间产物。将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)  NH2COONH4(s)
NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①关于上述反应的焓变、熵变说法正确的是 。
A.∆H<0 ,∆S<0 B.∆H>0, ∆S<0 C.∆H>0, ∆S>0 D.∆H<0, ∆S>0
②关于上述反应的平衡状态下列说法正确的是________________
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
 C.NH3的转化率始终等于CO2的转化率
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底。将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素。
此时溶液中c(NH4+)= ;
NH4+水解平衡常数值为 。
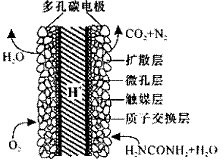
化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电。尿素燃料电池结构如图所示,写出该电池的负极反应式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活密切相关,下列说法正确的是:
A 制作航天服的聚酯纤维属于新型无机非金属材料
B 银器久置后表面会变暗,是因为发生了电化学腐蚀
CLi是最轻的金属也是活动性很强的金属,是制造电池的理想物质
D海水提取溴、煤的液化、焰色反应都发生了化学变化。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是:
A. 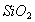 是酸性氧化物,能与溶液反应
是酸性氧化物,能与溶液反应
B. 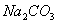 和
和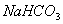 都是盐,都能与溶液反应
都是盐,都能与溶液反应
C.  和
和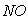 都是大气污染物,在空气中都能稳定存在
都是大气污染物,在空气中都能稳定存在
D. Al在浓盐酸中会“钝化”,能用铝槽盛放浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
以化学反应原理为依据,以实验室研究为基础,可以实现许多化工生产。
I分解水制取氢气的工业制法之一是“硫-碘循环法”,主要涉及下列反应:

分析上述反应,下列判断正确的是____。
循环过程中产生1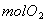 的同时产生
的同时产生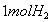
反应①中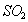 还原性比
还原性比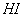 强
强
循环过程中需补充
反应③易在常温下进行
在一定温度下,向2L密闭容器中加入 ,发生反应②.物质的量随时间的变
,发生反应②.物质的量随时间的变 化如图所示。
化如图所示。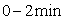 内的平均反应速率
内的平均反应速率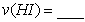
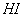 的转化率=_______
的转化率=_______
恒温恒容条件下,硫发生转化的反应过程和能量关系如图所示。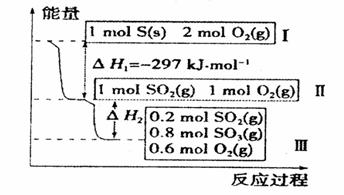 请回答下列问题:
请回答下列问题:
①写出能表示硫的燃烧热的热化学方程式_______;
②恒温恒容时,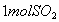 和
和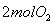 充分反应,放出热量的数值比
充分反应,放出热量的数值比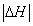 _____(填“大”、“小”或“相等”)
_____(填“大”、“小”或“相等”)
II.氮化硅(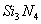 )是一种新型陶瓷材料,工业上有石英与焦炭在高温的氮气流中,通过以下反应制得:
)是一种新型陶瓷材料,工业上有石英与焦炭在高温的氮气流中,通过以下反应制得:

该反应平衡常数的表达式为K=_______.升高温度,其平衡常数
_________(填“增大”、“减少”或“不变”)。
(2)该化学反应速率与反应时间的关系如图所示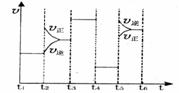
 时引
时引 起突变的原因是_____,
起突变的原因是_____,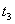 引起变化的因素是_____,
引起变化的因素是_____,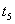 时引
时引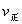 小变化、
小变化、 大变化的原因是_________.
大变化的原因是_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1。则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
B.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)====2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ·mol-1
C.C2H6的燃烧热为Q kJ·mol-1,则表示C2H6燃烧热的热化学方程式为2C2H6(g)+7O2(g)====4CO2(g)+6H2O(l) ΔH=-2Q kJ·mol-1
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
正丁醚常用作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH (CH3CH2CH2CH2)2O,反应物和产物的相关数据如下表:
(CH3CH2CH2CH2)2O,反应物和产物的相关数据如下表:
| 相对分子质量 | 沸点/℃ | 密度/(g/cm3) | 水中的溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
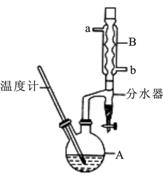 ①将6 mL浓硫酸和37 g正丁醇,按一定顺序添加到A中,并加几粒沸石。
①将6 mL浓硫酸和37 g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
③分离提纯:待A中液体冷却后将其缓慢倒入盛有70 mL水的温度分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40 mL水、20 mL NaOH溶液和40 mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11 g。请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为:应先加 。
(2)加热A前,需先从 (填“a”或“b”)口向B中通入水。
(3)步骤③的目的是初步洗去 ,振摇后静置,粗产物应
(填“上”或“下”)口倒出。
(4)步骤③中最后一次水洗的目的为 。
(5)步骤⑤中,加热蒸馏时应收集 (填选项字母)左右的馏分。
A.100℃ B.117℃ C.135℃ D.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分为 ,下层液体的主要成分为 。
(7)本实验中,正丁醚的产率为 (精确到1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知热化学方程式:
2H2O(l)===2H2(g)+O2(g) ΔH=571.6 kJ·mol-1
2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1
当1 g液态水变为气态水时,对其热量变化的下列描述:①放热;②吸热;③2.44 kJ;
④4.88 kJ;⑤88 kJ。其中正确的是( )
A.②和⑤ B.①和③ C.②和④ D.②和③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com