
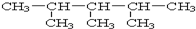 :2,3,4-三甲基戊烷.
:2,3,4-三甲基戊烷.分析 (1)烷烃命名原则:
①长-----选最长碳链为主链;
②多-----遇等长碳链时,支链最多为主链;
③近-----离支链最近一端编号;
④小-----支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简-----两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;
(2)用水煤气合成甲醇(CH30H),反应物为CO、H2,O元素以甲醇存在,则反应物的物质的量比为1:2.
解答 解:(1)最长碳链有5个碳,名称为:2,3,4-三甲基戊烷,故答案为:2,3,4-三甲基戊烷;
(2)用水煤气合成甲醇(CH30H),反应物为CO、H2,O元素以甲醇存在,则反应物的物质的量比为1:2,则反应为CO+2H2 $\stackrel{催化剂}{→}$ CH3OH,故答案为:CO+2H2 $\stackrel{催化剂}{→}$ CH3OH.
点评 本题考查有机物的命名以及化学反应方程式的书写,为高频考点,把握反应物、生成物及质量守恒定律为解答的关键,侧重分析与应用能力的考查,注意氧元素在生成物中的存在形式,题目难度不大.


科目:高中化学 来源: 题型:选择题
 某兴趣小组用如图装置制备气体(酒精灯可以根据需要选择),对应说法正确的是( )
某兴趣小组用如图装置制备气体(酒精灯可以根据需要选择),对应说法正确的是( )| 选项 | ①药品 | ②中药品 | ③中药品 | ④中药品 | 制备气体 | ⑥中药品及作用 |
| A | 浓盐酸 | MnO2 | 饱和食盐水 | 浓硫酸 | Cl2 | NaOH溶液,尾气吸收 |
| B | 稀硝酸 | Cu | 烧碱溶液 | 浓硫酸 | NO | NaOH溶液,尾气吸收 |
| C | 浓盐酸 | 大理石 | 饱和Na2CO3溶液 | 浓硫酸 | CO2 | 澄清石灰水,检验 |
| D | 浓盐酸 | Zn | 水 | 浓硫酸 | H2 | 撤去 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇分子中含有羟基 | |
| B. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| C. | 75%的乙醇溶液常用于医疗消毒 | |
| D. | 只用水无法鉴别苯和四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色褪去可证明BaCl2溶液显酸性 | |
| B. | 根据盐溶液的酸碱性,将盐分成酸式盐、正盐和碱式盐 | |
| C. | 泡沫灭火器是利用硫酸铝溶液和碳酸钠溶液反应产生大量CO2和Al(OH)3灭火 | |
| D. | NH4F溶液中含有少量的HF,因此NH4F溶液不能存放于玻璃试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
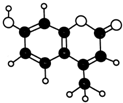
| A. | 分子式为C11H9O3 | B. | 不能使溴水褪色 | ||
| C. | 属于芳香族化合物 | D. | 不能与Na0H溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯能使酸性高锰酸钾溶液褪色,是因为乙烯分子中含有碳碳双键 | |
| B. | 苯可以使溴水褪色,是发生了加成反应 | |
| C. | 乙醛在一定条件下与氧气反应生成乙酸,乙醛发生了氧化反应 | |
| D. | 氨基酸分子中均含有羧基(-COOH)和氨基(-NH2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
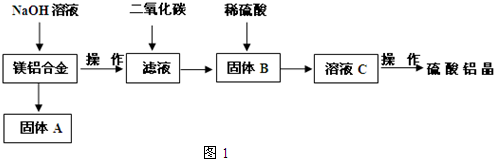
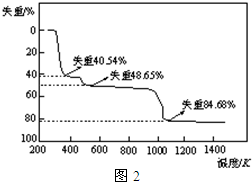 (5)取上述硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:323K-523K,553K-687K,1043K以上不再失重,其热分解的TG曲线见图2,已知:失重%=$\frac{加热减少的质量}{原晶体样品的总质量}$×100%.根据图示数据计算确定每步分解的产物,写出第一阶段分解产物的化学式Al2(SO4)3.3H2O,第三阶段反应化学方程式Al2(SO4)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3SO3↑.
(5)取上述硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:323K-523K,553K-687K,1043K以上不再失重,其热分解的TG曲线见图2,已知:失重%=$\frac{加热减少的质量}{原晶体样品的总质量}$×100%.根据图示数据计算确定每步分解的产物,写出第一阶段分解产物的化学式Al2(SO4)3.3H2O,第三阶段反应化学方程式Al2(SO4)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3SO3↑.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com