
| A. | 9种 | B. | 16种 | C. | 19种 | D. | 25种 |
分析 根据有机物能够发生水解反应,则应含有-COO-官能团,则取代基分别为-CH3和-OOCH或-OOCCH3或-CH2OOCH或-COOCH3、有2个取代基时,有邻、间、对三不同结构.根据氢原子的种类等于一溴代物的种类.
解答 解:由题目要求可知该有机物的同分异构体中应具有CH3-C6H4-OOCH(-C6H4-为苯环)的结构,应有邻、间、对三种同分异构体或C6H5-OOCCH3或C6H5-CH2OOCH或C6H5-COOCH3,共6种,对应产物的苯环上的一溴代物有4种、4种、2种、3种、3种、3种,共19种,故选C.
点评 本题考查了同分异构体的确定,难度中等,注意有机物结构的确定是解题的关键.


科目:高中化学 来源: 题型:选择题
| 选项 | 已知溶液 | 大量存在的离子 |
| A | NH4HCO3溶液 | K+、Na+、NO3-、Cl- |
| B | FeCl3溶液 | Fe2+、NH4+、SCN-、SO42- |
| C | 中性溶液 | Cu2+、K+、Cl-、SO42- |
| D | CH3COOH溶液 | NH4+、Na+、SO42-、CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
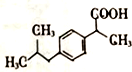

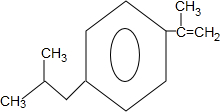 +H2O$→_{△}^{催化剂}$
+H2O$→_{△}^{催化剂}$ .
.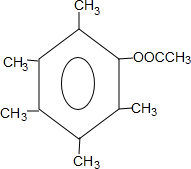 或
或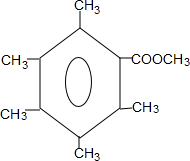 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
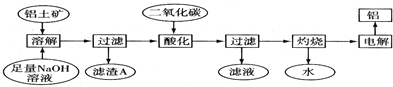
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com