
分析 ①盐酸不能与金属铜反应,但可以与氧化铜反应,所以双氧水的作用是将金属铜氧化为CuO,然后氧化铜溶于盐酸;
②n(KI)=0.06mol,与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则n(I2)=n(KIO3)=0.02mol,结合化合价的变化计算转移的电子的数目,可计算消耗KMnO4的物质的量;
③先由棕黄色变为浅绿色,过一会又变为棕黄色,则Fe3+先被还原后又氧化.
解答 解:①盐酸不能与金属铜反应,但可以与氧化铜反应,所以双氧水的作用是将金属铜氧化为CuO,然后氧化铜溶于盐酸,该反应的化学方程式为:Cu+2HCl+H2O2=CuCl2+2H2O,
故答案为:Cu+2HCl+H2O2=CuCl2+2H2O;
②n(KI)=0.06mol,与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则n(I2)=n(KIO3)=0.02mol,共失去电子的物质的量为2×0.02mol+0.02mol×[5-(-1)]=0.16mol,则消耗KMnO4的物质的量的是n=$\frac{0.16mol}{7-2}$=0.032mol,
故答案为:0.032;
③先由棕黄色变为浅绿色,过一会又变为棕黄色,则Fe3+先被还原后又氧化,先变为浅绿色的离子方程式是2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,后变为棕黄色的原因是H+与NO3-组成的硝酸将Fe2+氧化,
故答案为:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及分析应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
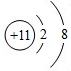
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于D、C、E元素的氢化物相对分子质量依次减小,所以其沸点依次降低 | |
| B. | 元素D和E的某些单质不可以作为水处理中的消毒剂 | |
| C. | 元素B的单质只能与氢氧化钠溶液反应而不能与任何酸反应 | |
| D. | A、E两种元素能形成A2E和A2E2型化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
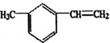 下列说法正确的是( )
下列说法正确的是( )| A. | 分子中所有碳原子可能处于同一平面上 | |
| B. | 分子中至少有7个碳原子一定处于同一平面上 | |
| C. | 分子中所有原子有可能处于同一平面上 | |
| D. | 分子中至多有16个原子处于同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com