
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是
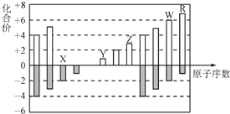
A. 离子半径:X>Y>Z
B. WX3和水反应形成的化合物是离子化合物
C. 最高价氧化物对应的水化物酸性:R>W
D. Y和Z两者最高价氧化物对应的水化物能相互反应
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:
2FeSO4 + 6Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑该反应中还原剂是________________。(填化学式)
(2)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:_____________。
②每生成2mol FeO42-转移________mol电子,若反应过程中转移了0.5mol电子,则还原产物的物质的量为________mol。
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和1 mol FeBr2的溶液中通入2.5 mol Cl2,此时依次被氧化的离子是__________,被氧化的离子对应的物质的量之比是________________。
(2)若向含a mol FeI2和b mol FeBr2的混合溶液中通入c mol Cl2,当该混合溶液与通入的Cl2恰好完全反应时,a、b、c的关系为______________________(用含a、b、c的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2在O2中燃烧的反应为2H2+O2=2H2O,反应前后没有发生变化的是( )
①元素的种类 ②分子的数目 ③ 物质的总能量 ④物质的总质量
A. ①③ B. ②③ C. ①④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组模拟工业生产制取HNO3设计下图所示装置,其中a为一个可持续鼓入空气的橡皮球。请回答下列问题。
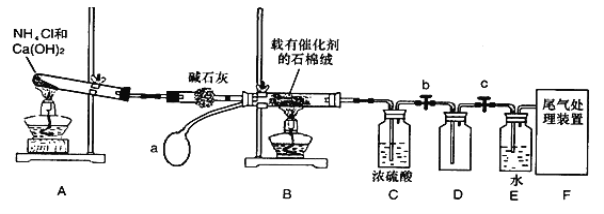
(1)写出装置B中主要反应的化学方程式 ________________________。
(2)装置E中主要反应的化学方程式______________________________。
(3)装置C中浓硫酸的作用是________________________________。
(4)请你帮助该化学小组设计实验室制取NH3的另一方案_________________________。
(5)装置D中的主要作用是 _______________________。
(6)干燥管中的碱石灰用于干燥NH3,某同学思考是否可用无水氯化钙代替碱石灰,并设计下图所示装置(仪器固定装置省略,挤出气体的气球紧套在玻璃管一端,玻璃管插在单孔橡胶塞上)进行验证。实验步骤如下:

①用烧瓶收集满干燥的氨气,立即塞上如图所示的橡胶塞。
②正立烧瓶,使无水氯化钙固体滑入烧瓶底部,摇动,可以观察到的现象是______,由此,该同学得出结论:不能用CaCl2代替碱石灰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酚酞是常用的酸碱指示剂,其结构简式如图所示: 。
。
(1)酚酞的分子式为________。
(2)从结构上看酚酞可看作(填字母序号) ________。
A.烯烃 B.芳香化合物
C.醇类物质 D.酚类物质
E.醚类物质 F.酯类物质
(3)酚酞结构简式中画虚线的地方,组成的是醚键吗________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列烷烃的命名是否正确?若有错误加以改正,把正确的名称填在横线上:
(1) 2-乙基丁烷 _____________________________________;
2-乙基丁烷 _____________________________________;
(2)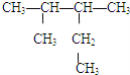 3,4-二甲基戊烷 ________________________________;
3,4-二甲基戊烷 ________________________________;
(3)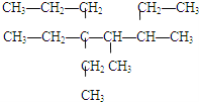 5-甲基-4,6三乙基庚烷 ____________________。
5-甲基-4,6三乙基庚烷 ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关Na2CO3和NaHCO3的性质,下列叙述中错误的是( )
A. 相同温度下,等浓度的Na2CO3溶液和NaHCO3溶液的碱性比较,前者更强
B. 常温时水溶性:Na2CO3>NaHCO3
C. 在酒精灯加热的条件下,前者不分解,后者分解
D. 将澄清的石灰水分别加入Na2CO3和NaHCO3溶液中,前者产生沉淀,后者不产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A,B,C,D,E,F均为周期表中前36号元素,且原子序数依次增大.A,B,C为同一周期的主族元素,B原子p能级电子总数与s能级电子总数相等.A,F原子未成对电子是同周期中最多的,且F基态原子中电子占据三种不同形状的原子轨道.D和E原子的第一至第四电离能如下表所示:

(1)A,B,C三种元素的电负性最大的是__(填写元素符号),D,E两元素中D的第一电离能较大的原因是__.
(2)F基态原子的核外电子排布式是__;在一定条件下,F原子的核外电子从基态跃迁到激发态产生的光谱属于__光谱(填“吸收”或“发射”).
(3)根据等电子原理,写出AB+的电子式:__.
(4)已知:F3+可形成配位数为6的配合物.组成为FCl36H2O的配合物有3种,分别呈紫色、蓝绿色、绿色,为确定这3种配合物的成键情况,分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3:2:1.则绿色配合物的化学式为__.
A.[CrCl(H2O)5]Cl2H2O B.[CrCl2(H2O)4]Cl2H2OC.[Cr(H2O)6]Cl3D.[CrCl3(H2O)3]3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com