
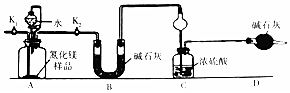
分析 A中氮化镁和水反应生成氨气和氢氧化镁,B干燥氨气,氨气极易溶于浓硫酸,易产生倒吸现象,D干燥空气,防止空气中水蒸气被浓硫酸吸收,
(1)氮化镁和水反应生成氨气和氢氧化镁;
(2)导致的干燥管有缓冲作用;
(3)有连接的仪器在使用前必须检验装置气密性,打开K2关闭 K1,打开分液漏斗使氮化镁和水反应生成氨气,打开所有止水夹后通入氮气一段时间,将生成的氨气完全被浓硫酸吸收,浓硫酸增加的质量等于氨气质量;
(4)根据N原子守恒计算氮化镁质量,氮化镁纯度=$\frac{氮化镁质量}{氮化镁样品质量}×100%$;
(5)若去掉装置D,则导致空气中水蒸气被浓硫酸吸收.
解答 解:A中氮化镁和水反应生成氨气和氢氧化镁,B干燥氨气,氨气极易溶于浓硫酸,易产生倒吸现象,D干燥空气,防止空气中水蒸气被浓硫酸吸收,
(1)氮化镁和水反应生成氨气和氢氧化镁,反应方程式为Mg3N2+6H2O=2NH3↑+3Mg(OH)2↓,故答案为:Mg3N2+6H2O=2NH3↑+3Mg(OH)2↓;
(2)导致的干燥管有缓冲作用,所以能防倒吸,故答案为:防倒吸;
(3)有连接的仪器在使用前必须检验装置气密性,所以该实验在使用前必须检验装置气密性;打开K2关闭 K1,打开分液漏斗使氮化镁和水反应生成氨气,打开所有止水夹后通入氮气一段时间,将生成的氨气完全被浓硫酸吸收,浓硫酸增加的质量等于氨气质量,要测定氮化镁纯度应该知道氨气质量,所以需要测定C装置质量,所以通入氮气的目的是把装置中残留的氨气全部赶入C装置,
故答案为:检验装置气密性; K2; K1;C;把装置中残留的氨气全部赶入C装置;
(4)根据N原子守恒得Mg3N2~2NH3,氮化镁纯度=$\frac{氮化镁质量}{氮化镁样品质量}×100%$=$\frac{\frac{\frac{bg}{17g/mol}}{2}×1×100g/mol}{ag}$×100%=$\frac{50b}{17a}×100%$,
故答案为:$\frac{50b}{17a}×100%$;
(5)若去掉装置D,则导致空气中水蒸气被浓硫酸吸收,部分水蒸气被当作氨气,所以测定结果偏高,
故答案为:偏高.
点评 本题考查物质含量测定,为高频考点,侧重考查学生实验操作、实验分析及评价能力,明确化学反应原理、元素化合物性质是解本题关键,知道各个装置的作用,易错点是(5)题.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | CCl4可用于鉴别溴水和碘水 | |
| C. | 漂白粉在空气中不稳定,因此可用于漂白纸张 | |
| D. | 用乙醇萃取的方法可以分离溶于水的碘,是因为碘在乙醇中的溶解度较大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.0 mol | B. | 1.5mol | C. | 1.0mol | D. | 0.75mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若实验室发生火灾,应立即打开门窗(或排风扇)通风透气 | |
| B. | 实验结束后,用嘴吹熄酒精灯 | |
| C. | 皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗 | |
| D. | 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断的搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去).下列说法错误的是( )
甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去).下列说法错误的是( )| A. | 若戊为一种强碱且焰色反应为黄色,则上述反应可能都属于氧化还原反应 | |
| B. | 常温下,若丙为无色气体,戊为红棕色气体,则甲、乙一定是铜和稀硝酸 | |
| C. | 若甲为硫磺燃烧产物,丁为水,则戊可用于干燥甲 | |
| D. | 若甲为浓盐酸,乙为MnO2,则戊可能使品红褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
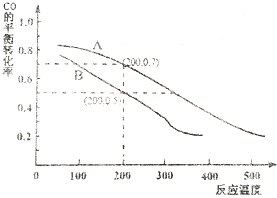
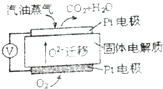
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
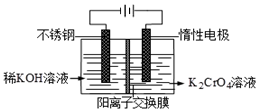 已知重铬酸钾(K2Cr2O7)是一种中学实验室常用的强氧化剂.重铬酸钾溶液中存在以下平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙红色)+H2O.
已知重铬酸钾(K2Cr2O7)是一种中学实验室常用的强氧化剂.重铬酸钾溶液中存在以下平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙红色)+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com