
下图是某同学用500 mL容量瓶配制0.10 mol·L-1 NaOH溶液的过程:
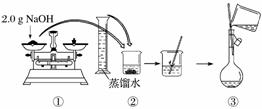
该同学的错误步骤有( )
A.1处 B.2处 C.3处 D.4处
科目:高中化学 来源: 题型:
有机物A分子式为C2H4,可发生以下系列转化,已知B、D是生活中常见的两种有机物,下列说法不正确的是( )
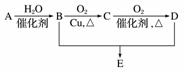
A.75%的B溶液常用于医疗消毒
B.D、E都能与NaOH溶液反应
C.B、D、E三种物质可以用饱和Na2CO3溶液鉴别
D.由B、D制备E常用浓硫酸作脱水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
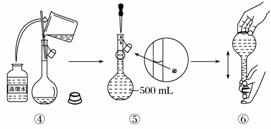
实验室需要配制0.50 mol·L-1 NaCl溶液480 mL。
按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(带砝码、最小砝码为5 g)、药匙、烧杯、 、 、 以及等质量的两片滤纸。
(2)计算。配制该溶液需取NaCl晶体 g。
(3)称量。
①天平调平之后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:

②称量过程中NaCl晶体应放于天平的 (填“左盘”或“右盘”)。
③称量完毕,将药品倒入烧杯中。
(4)溶解、冷却。该步实验中需要使用玻璃棒,目的是 。
(5)转移、洗涤。在转移时应使用玻璃棒引流,需要洗涤烧杯2~3次是为了 。
(6)定容。向容量瓶中加水至液面接近刻度线 处,改用 加水,使溶液凹液面与刻度线相切。
(7)摇匀、装瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1 ,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是( )
A.ρ=(17V+22 400)/(22.4+22.4V)
B.w=17c/(1 000ρ)
C.w=17V/(17V+22 400)
D.c=1 000Vρ/(17V+22 400)
查看答案和解析>>
科目:高中化学 来源: 题型:
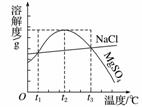
右图是NaCl、MgSO4的溶解度曲线。下列说法正确的是( )
A.只有在t1 ℃时,NaCl和MgSO4的溶解度才相等
B.t1~t2 ℃,MgSO4的溶解度随温度升高而减小
C.在t2 ℃时,MgSO4饱和溶液的溶质质量分数最大
D.把MgSO4饱和溶液的温度从t3 ℃降至t2 ℃时,有晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态镍原子的外围电子排布式为 。
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式 、 。
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2=CH2、②HC≡CH、③ 、④HCHO,其中碳原子采取sp2杂化的分子有
、④HCHO,其中碳原子采取sp2杂化的分子有
(填物质序号),HCHO分子的立体结构为 形。
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为 。

(5)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如右上图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键。
查看答案和解析>>
科目:高中化学 来源: 题型:
反应4A(g) 2B(g)+E(g) △H>0。达到平衡时,欲使正反应速率降低,A的浓度增大,应采取的措施是( )
2B(g)+E(g) △H>0。达到平衡时,欲使正反应速率降低,A的浓度增大,应采取的措施是( )
| A.加压 | B.减压 | C.升温 | D.减少E的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com