
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| A、少量二氧化碳通入NaClO溶液中:2NaClO+CO2+H2O→Na2CO3+2HClO |
| B、过量的 HCN滴入碳酸钠溶液中 HCN+Na2CO3→NaCN+NaHCO3 |
| C、结合质子能力由强到弱的顺序为:CO32->CN->HCO3->CH3COO- |
| D、常温下电离常数:Ki2(H2CO3)>Ki(C6H5OH)>Ki(HCN) |


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
| A、在纸上层析操作时,要让试样点刚好接触展开剂,否则不能很好地分离 |
| B、实验室制备硝基苯时,先将浓硫酸滴入浓硝酸后,冷却,再边振荡边滴加苯 |
| C、从海带中提取碘的方法是:取样→灼烧→溶解→过滤→萃取 |
| D、向盛有少量Na2O2的试管中加入少量水,并立即滴入2滴酚酞,振荡,溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
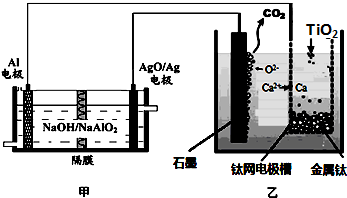
| A、乙装置阴极的电极反应式为TiO2+4e-═Ti+2O2- |
| B、若不考虑能量的损失,制备24.0g金属钛,需要消耗金属铝36.0g |
| C、甲装置工作过程中OH-向AgO/Ag极移动;乙装置工作过程中O2-向钛网移动 |
| D、乙装置中的石墨电极需要定期更换 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C分别是( )
A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C分别是( )| A、Be Na Al |
| B、B Mg Si |
| C、O P Cl |
| D、C Al P |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:C>D>B>A |
| B、A、D、E最高价氧化物对应水化物酸性增强 |
| C、只含B元素的物质一定是纯净物 |
| D、化合物C2AB3的水溶液显碱性,可用于洗去铜片表面的油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
| A、增大氧气浓度,平衡向正方向移动,K值不变 |
| B、降低温度,正反应速率比逆反应速率减小的程度小 |
| C、平衡时SO2气体的转化率为50% |
| D、该条件下反应放出0.5QkJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
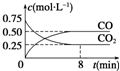 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,1 100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,1 100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.| 容器 | 甲 | 乙 |
| 反应物投入量 | 3mol Fe、 2mol CO2 | 4mol FeO、 3mol CO |
| CO的浓度(mol?L-1) | c1 | c2 |
| CO2的体积分数 | φ1 | φ2 |
| 体系压强(Pa) | p1 | p2 |
| 气态反应物的转化率 | α1 | α2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com