
����Ŀ��ijʵ��С��ͬѧ������������̽��Fe3����ˮ��Һ�е���Ϊ��
���ϣ�
��.Fe3����ˮ��Һ����ˮ�������ӵ���ʽ���ڣ���[Fe(H2O)6]3����[Fe(H2O)6]3����������ˮ�ⷴӦ��
[Fe(H2O)6]3��(������ɫ)��nH2O![]() [Fe(H2O)6��n(OH)n]3��n(��ɫ)��nH3O��(n��0��6)��
[Fe(H2O)6��n(OH)n]3��n(��ɫ)��nH3O��(n��0��6)��
��.[FeCl4(H2O)2]��Ϊ��ɫ��
����ʵ�飺
��ʵ���
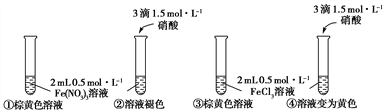
��ʵ���
�ֱ����Թܢ١����е��Լ���Ϊ����Һ����ɫ�ȼƲⶨ�����ʡ�����ԽС����Һ��ɫԽ�����Խ����Һ��ɫԽdz��
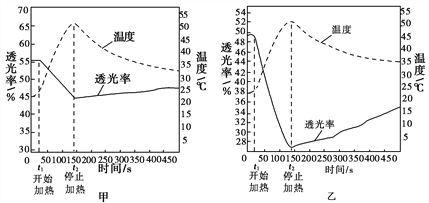
Fe(NO3)3��Һ�������¶ȱ仯���ߡ�FeCl3��Һ�������¶ȱ仯����
��1��ʵ����У��Թܢ���Һ��ɫ��ԭ����_________________________________________��
��2��ʵ����У��Թܢ���Һ���ػ�ɫ��[FeCl4(H2O)2]���йأ�֧�ִ˽��۵�ʵ��������_____________________________________________________________________________��
��3����ʵ���ͼ�ס��ҿ�֪������ʱ����Һ��ɫ________(���dz����������䡱)��
��4����ʵ����Եó����½��ۣ�
������һ��FeCl3��Һ�д��ڿ��淴Ӧ��[FeCl4(H2O)2]����4H2O![]() [Fe(H2O)6]3����4Cl���ó��˽��۵�������_______________________________________________________��
[Fe(H2O)6]3����4Cl���ó��˽��۵�������_______________________________________________________��
�����۶�������һ�з�Ӧ�Ħ�H________(�>0����<0��)��
��5��ʵ��С��ͬѧ���������һ��ʵ��֤��(4)�н���һ��ʵ�鷽����ȡ�Թܢ�����Һ��_______________________(��������Ҫ��ʵ�����������)��
���𰸡� ����֪��[Fe(H2O)6]3����nH2O![]() [Fe(H2O)6��n(OH)n]3��n��nH3O��������HNO3����c(H��)����������ƽ�������ƶ�����Һ�ɻ�ɫ��Ϊ��ɫ �Թ��ڡ����зֱ���������HNO3����������Һ��ɫ����������Һ�ʻ�ɫ ���� ������ͬ�¶�ʱ��FeCl3��Һ�������¶ȱ仯�������Դ���Fe(NO3)3��Һ��˵����FeCl3��Һ�д���ˮ�������ӵ�ˮ��ƽ��֮����������[FeCl4(H2O)2]����4H2O
[Fe(H2O)6��n(OH)n]3��n��nH3O��������HNO3����c(H��)����������ƽ�������ƶ�����Һ�ɻ�ɫ��Ϊ��ɫ �Թ��ڡ����зֱ���������HNO3����������Һ��ɫ����������Һ�ʻ�ɫ ���� ������ͬ�¶�ʱ��FeCl3��Һ�������¶ȱ仯�������Դ���Fe(NO3)3��Һ��˵����FeCl3��Һ�д���ˮ�������ӵ�ˮ��ƽ��֮����������[FeCl4(H2O)2]����4H2O![]() [Fe(H2O)6]3����4Cl�� <0 �ȵμ�HNO3���ٵμӼ���NaCl��Һ���������Һ�������¶ȸı�ı仯�������ͨ�����ϲ�������������ɫ�ٱ�ƺ����Һ���������¶����߶���С�����¶��½���������֤����(4)�н���һ(������������)
[Fe(H2O)6]3����4Cl�� <0 �ȵμ�HNO3���ٵμӼ���NaCl��Һ���������Һ�������¶ȸı�ı仯�������ͨ�����ϲ�������������ɫ�ٱ�ƺ����Һ���������¶����߶���С�����¶��½���������֤����(4)�н���һ(������������)
����������1������֪��[Fe(H2O)6]3����nH2O![]() [Fe(H2O)6��n(OH)n]3-n��nH3O������������Һ�м���HNO3����Һ��������Ũ��������ƽ�������ƶ�����Һ�ɻ�ɫ��Ϊ��ɫ���ʴ�Ϊ������֪��[Fe(H2O)6]3����nH2O
[Fe(H2O)6��n(OH)n]3-n��nH3O������������Һ�м���HNO3����Һ��������Ũ��������ƽ�������ƶ�����Һ�ɻ�ɫ��Ϊ��ɫ���ʴ�Ϊ������֪��[Fe(H2O)6]3����nH2O![]() [Fe(H2O)6��n(OH)n]3-n��nH3O��������HNO3��c(H��)������ƽ�������ƶ�����Һ�ɻ�ɫ��Ϊ��ɫ��
[Fe(H2O)6��n(OH)n]3-n��nH3O��������HNO3��c(H��)������ƽ�������ƶ�����Һ�ɻ�ɫ��Ϊ��ɫ��
��2���Թܢ������м��������HNO3������Һ��ɫ����������Һ�Գʻ�ɫ��˵���Ȼ�����Һ��ɫΪ[FeCl4��H2O��2]-���£��ʴ�Ϊ���Թܢ������м��������HNO3������Һ��ɫ����������Һ�Գʻ�ɫ��
��3���¶����ߣ�����ƽ��[Fe��H2O��6]3++nH2O[Fe��H2O��6-n��OH��n]3-n+nH3O+�����ƶ���[Fe��H2O��6-n��OH��n]3-nŨ��������Һ��ɫ����ʴ�Ϊ�����
��4��������ͬ�¶�ʱ��FeCl3��Һ�������¶ȱ仯�������Դ���Fe��NO3��3��Һ��˵����FeCl3��Һ�д���ˮ�������ӵ�ˮ��ƽ��֮�⣬������[FeCl4��H2O��2]-+4H2O[Fe��H2O��6]3++4Cl-�������¶���FeCl3��Һ��������ƽ�������ƶ�������ӦΪ���ȷ�Ӧ���ʴ�Ϊ��������ͬ�¶�ʱ��FeCl3��Һ�������¶ȱ仯�������Դ���Fe��NO3��3��Һ��˵����FeCl3��Һ�д���ˮ�������ӵ�ˮ��ƽ��֮�⣬������[FeCl4��H2O��2]-+4H2O[Fe��H2O��6]3++4Cl-����0��
��5������ʵ��ڢܿ�֪����ڵ���Һ�м��뺬�����������ʣ�������Һ��[FeCl4��H2O��2]-Ũ�ȣ�����֤��ʵ�鷽����֤��4���н��ۣ��ʴ�Ϊ���ȵμ�HNO3���ٵμӼ���NaCl��Һ���������Һ�������¶ȸı�ı仯�������ͨ�����ϲ�������������ɫ�ٱ�ƺ����Һ���������¶����߶���С�����¶��½���������֤����(4)�н���һ��


 ѧ���쳵��������������������ϵ�д�
ѧ���쳵��������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���Ӧ�������۶���ȷ�������߾��������ϵ����
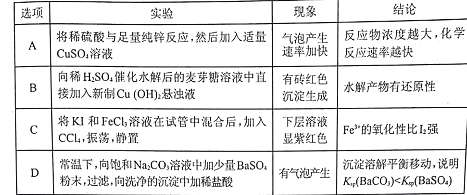
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ࡢ��֬�͵�������ά�����������������Ӫ�����ʡ������й�˵����ȷ���� (����)
A.����Ӫ�����ʾ�������Ȼ�߷��ӻ�����
B.ʳ�õĵ����ʡ��Ǻ���֬���ɷ���ˮ�ⷴӦ
C.���ڷ�֯�����Ͳ�˿����Ҫ�ɷֶ�����ά��
D.75%�ƾ�������ɱ������״��������Ϊ�ƾ�ʹ�����ʱ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪723 Kʱ��2SO2��g��+O2��g��![]() 2SO3��g����H=��QkJ��
2SO3��g����H=��QkJ��![]() ������ͬ�����£���һ�ܱ�������ͨ��2mol SO2��1 mol O2���ﵽƽ��ʱ�ų�������ΪQ1kJ������һ�����ͬ���ܱ�������ͨ��1mol SO2��0.5mol O2���ﵽƽ��ʱ�ų�������ΪQ2kJ����Q1��Q2��Q����Ĺ�ϵ�ǣ� ��
������ͬ�����£���һ�ܱ�������ͨ��2mol SO2��1 mol O2���ﵽƽ��ʱ�ų�������ΪQ1kJ������һ�����ͬ���ܱ�������ͨ��1mol SO2��0.5mol O2���ﵽƽ��ʱ�ų�������ΪQ2kJ����Q1��Q2��Q����Ĺ�ϵ�ǣ� ��
A. Q2=![]() B. Q2��
B. Q2��![]() C. Q2��Q1��Q D. Q=Q1��Q2
C. Q2��Q1��Q D. Q=Q1��Q2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���������ȷ���ǣ� ��
A.����ʱ�����ɽ�����Һ���ձ���ֱ�ӵ���©����
B.��������ʱ��Ӧʹ������е�ˮ����ȫ���ɺ���ֹͣ����
C.��Һ����ʱ���ֽ���Һ©�����²�Һ����¿ڷų����ٽ��ϲ�Һ����¿ڷų�
D.ֻҪ��Һ������Ϳ���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��̲�����ˮ�ⷴӦ����(����)
A. ����ͷʱ,����������ζ
B. ������Һ��ϡ���Ṳ��һ��ʱ���,�μӵ�ˮ������ɫ
C. ������Ũ����մ��Ƥ���ϻ���ֻ�ɫ�ߺ�
D. ��֬������������Һ���ȿ����Ƶ÷���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ֳּ��������绯ѧ�����������ڲⶨO2����.��ͼΪij�����绯ѧ��������ԭ��ʾ��ͼ����֪�ڲⶨO2���������У��������Һ���������ֲ��䡣һ��ʱ���ڣ���ͨ���������Ĵ�������Ϊa L����״������ij�缫������bg������˵����ȷ����
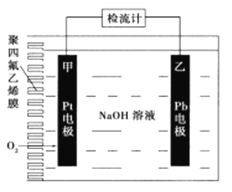
A. Pt�Ϸ���������Ӧ B. Pb�ϵĵ缫��ӦʽΪ4OH--4e-=O2��+2H2O
C. ��Ӧ������ת��OH-�����ʵ���Ϊ0.25bmol D. �����������������������Ϊ0.7b/a
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ��Ȼ�����һ�����;�ˮ��������������Ũ������c��ʾ��������������ҪΪAl3+�еĵ�����̬������Ala��ʾ����Ũ�ȣ���ҪΪ [AlO4Al12(OH)24(H2O)12]7+���еȾۺ���̬����Ũ������Alb��ʾ����Al(OH)3������̬������Alc��ʾ����Ũ�ȡ�
��1�����̼�Ȼ�ԭһ��������ʵ�����������Ʊ�����������ط�Ӧ���Ȼ�ѧ����ʽ������
��Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) ��H1=akJ��mol-1
��6AlCl(g)=4Al(s)+2AlCl3(g) ��H2=bkJ��mol-1
��ӦAl2O3(s) +3C(s)=2Al (s)+3CO(g) ˵����H=_______kJ��mol-1���ú�a��b�Ĵ���ʽ��ʾ����
_0( �>����<��)��
��Ӧ���ڳ�ѹ��1900���ĸ����²��ܽ��У�˵����H_______0�����������������=����
��2����Ĥ���������MD��Ũ���������ۺ��Ȼ�����Һ����Ũ����ʵ������в�ͬŨ�Ⱦۺ��Ȼ�����Һ������̬�ֲ����ٷ��������ұ���
AlT/��mol��L-1�� | Ala/% | Alb/% | A1c/% |
0.208 | 1.4 | 86.6 | 12.0 |
0.489 | 2.3 | 86.2 | 11.5 |
0.884 | 2.3 | 88.1 | 9.6 |
1.613 | 3.1 | 87.0 | 9.9 |
2.520 | 4.5 | 88.2 | 7.3 |
����һ���¶��£�AlTԽ����Al(OH)3����İٷֺ���________���Խ������ԽС�����䡱����
������c=2.520mol/L�ľۺ���������Һ��ˮϡ�ͣ���ϡ�����з�������Ҫ��Ӧ�����ӷ���ʽΪ_________________________________��
��3��һ�������£���1.0mol/L��AlCl��Һ�м���0.6mol/L��NaOH��Һ�����Ƶ�Alb����ԼΪ86% �ľۺ��Ȼ�����Һ��д������[AlO4Al12(OH)24(H2O)12]7+�����ӷ���ʽ��_________________________��
��4����֪Al3++4X![]() 2
2![]() ��X��ʾ��ɫ����
��X��ʾ��ɫ����![]() ��ʾ��ɫ���ʣ�ͨ����ɫ������
��ʾ��ɫ���ʣ�ͨ����ɫ������
��25 ��ʱAl3+Ũ����ʱ��ı仯��ϵ��ͼ��ʾ����ʼʱX��Ũ��Ϊ0.194 mol��L-1����
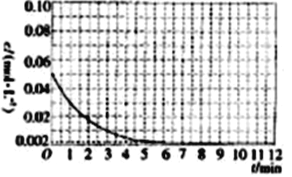
��1minʱ�� ![]() ��Ũ��Ϊ___________��
��Ũ��Ϊ___________��
��0��3min�ڸ÷�Ӧ������vx��________��
�۵�9minʱ����Ӧ�ﵽƽ�⣬K=__________���ô���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijdz��ɫ����X[x(NH4)2SO4��yFeSO4��zH2O]�ڷ�����ѧ�г�������ԭ��. Ϊȷ������ɣ�ijС��ͬѧ��������ʵ�飮
I��NH4+�IJⶨ
������������װ����ͼ��ʾ��
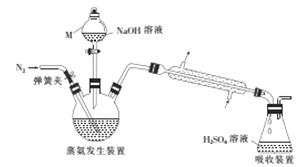
��ص�ʵ�鲽�����£�
��ȷ��ȡ58.80g����X����ˮ�ܽ����Һע��������ƿ�У�
��ȷ��ȡ50.00mL3.0300molL-1H2SO4��Һ����ƿ�У�
����������ƿ�м�������NaOH��Һ��ͨ�뵪��������������������ȡ����ƿ��
����0.120molL-1NaOH����Һ�ζ���ƿ�й��������ᣬ�ζ��յ�ʱ����25.00mL NaOH����Һ��
��1������M������Ϊ__________��
��2��������У�������������ԭ��Ӧ�Ļ�ѧ����ʽΪ____________������������Ϊ�˼���ʵ�����,����Ҫ��ֱ�������ܽ����������������������IJ���������_____________��
��3��������У�����ʱ��ƿ����Һ�彦����������õ�n(NH4+)��ֵ��______(����ƫ������ƫС������������)��
II.SO42-�����IJⶨ
����������������ʵ�鲽������:
����ȷ��ȡ58.80g����X ���ձ��У���ˮ�ܽ⣬�߽�����������BaCl2��Һ��
�ڽ��õ�����Һ������ֽ(�ҷ�������С,�ɺ���)���ˣ�ϴ�ӳ���3~4�Σ�
������ֽ�����ó���ȡ����������ֽ������ֽ��ȫ�һ���
�ܼ������ճ��������ء��������ó�������Ϊ69.90g��
��4���������,�ж�BeCl ��Һ�ѹ�����ʵ�������������___________��
��5���������,������ˮϴ����,����ҪĿ����___________��
��6�����ʵ����ͨ������ó�����X�Ļ�ѧʽΪ__________��ʵ��I �IJ������,��Һ�������ܶ��ɴ�С��˳��Ϊ___________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com