
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.2.0gD2中含有的中子数目为0.8NA
B.4.6gC2H6O中含有C—H键的数目一定为0.6NA
C.11.2L(标准状况)由甲烷和乙烯组成的混合气体中含有氢原子数目为2NA
D.常温下,将2.8gFe置于足量的浓硝酸中,转移的电子数目—定为0.15NA
【答案】C
【解析】
A.D为氘原子,其中子数为1,D2的相对分子质量为4,则2.0gD2的物质的量为0.5mol,则其中子的物质的量为2×0.5mol=1mol,中子数目为1NA,A错误;
B.C2H6O可能是乙醇,其结构简式为CH3CH2OH,1mol乙醇中含有5molC-H键,4.6g乙醇的物质的量为0.1mol,其含有的C-H键的数目为0.5NA,因此不一定是0.6NA,B错误;
C.甲烷的分子式CH4,乙烯的分子式为C2H4,分子中均含有4个H原子,标准状况下,11.2L混合气体的物质的量为![]() ,则混合物气体含有H原子的物质的量为4×0.5mol=2mol,其H原子数为2NA,C正确;
,则混合物气体含有H原子的物质的量为4×0.5mol=2mol,其H原子数为2NA,C正确;
D.常温下,Fe与浓硝酸会钝化,生成一层致密的氧化膜会阻止反应的进一步反生,因此不能计算转移的电子数,D错误;
答案选C。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Mg2+、NH4+、Al3+、Fe3+、CO32—、SO42—、Cl—中的几种。若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是
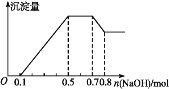
A. 溶液中的阳离子有H+、Mg2+、NH4+、Al3+
B. 溶液中n(Al3+)=0.1 mol
C. 溶液中一定不含CO32—,可能含有SO42—和Cl—
D. n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读、分析下列两个材料:
材料一:
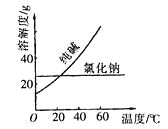
材料二:
物质 | 熔点/℃ | 沸点/℃ | 密度/ | 溶解性 |
乙二醇 |
| 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
回答下列问题(填序号):
A. 蒸馏法 B. 萃取法 C. “溶解、结晶、过滤”的方法 D. 分液法
①将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用_________。
②将乙二醇和丙三醇相互分离的最佳方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各装置不能达到实验目的是
A.利用①吸收多余的氨气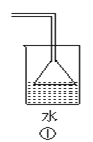
B.装置②可用于除去Cl2中的HCl
C.装置③可用于干燥氨气
D.装置④可用于排空气法收集H2、CO2、Cl2、HCl等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度均为0.1 mol/L的下列溶液:
①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)___________________________。
(2)④、⑤、⑦、⑧四种溶液中NH4+浓度由大到小的顺序是(填序号)________ 。
(3)将②、③混合后,若溶液呈中性,则消耗两溶液的体积为 ② ________ ③(填“>”、“<”或“=”)溶液中的离子浓度由大到小的顺序为______________________________
(4)常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液,判断:
①其中有两种粒子的物质的量之和一定等于0.010 mol,它们是________和________。
②溶液中c(CH3COO-)+n(OH-)-n(H+)=________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学中常用的物理量,请完成以下有关其计算的内容。
(1)0.2 g H2含有___________________个H原子。
(2)100 mL 某Al2(SO4)3溶液中,c(Al3+) = 2.0 mol/L,则其中c(SO42-) = _________mol/L。
(3)等质量的HCl、NH3、CO2、O2四种气体,在相同温度和相同压强条件下,体积最大的是________。
(4)当CO、CO2的分子个数之比为1:2时,原子总数之比为___________,质量之比为________;标准状况下,密度之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向0. 1 mol L-1 H2 A溶液中缓慢加入氢氧化钠(假设溶液体积不变),得到有关粒子的物质的量浓度分数与溶液pH值关系如图所示(M、N点对应的横坐标为6. 4和10.2)。 [![]() ]下列说法正确的是
]下列说法正确的是

A.Ka1(H2A)的数量级为10-5
B.N 点溶液中 c(Na+)>3c(HA-)
C.当溶液呈中性时,c(HA-)=c(Na+) >c(OH-)=c(H+)
D.由图可知HA-的水解程度小于电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示①②③三个容器,①②容器体积均为VL,③体积为0.5VL,若起始温度相同,分别向①②通入2molA,向③中通入2molB,发生如下反应:2A(g)![]() B(g) △H<0,则达到平衡时各容器内B的体积分数由大到小的顺序为( )
B(g) △H<0,则达到平衡时各容器内B的体积分数由大到小的顺序为( )
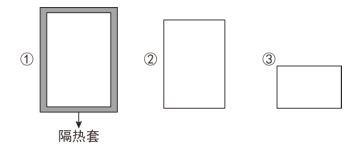
A.①②③
B.③①②
C.③②①
D.②③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组对金属钠进行研究。已知C、D都是单质,F的水溶液是一种常见的强酸。
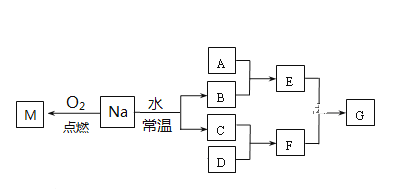
(1)金属Na在空气中放置足够长时间,最终的生成物是:______。
(2)若A是一种常见金属单质,且A与B溶液能够反应,写出该反应的化学方程式__________。
(3)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,请写出白色絮状沉淀转变成红褐色沉淀过程发生化学反应的方程式:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com