
| 20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |

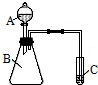
分析 根据流程图知,①中发生反应3MnO2+KClO3+6KOH$\frac{\underline{\;熔化\;}}{\;}$3K2MnO4+KCl+3H2O,冷却后捣碎加入蒸馏水并煮沸,然后过滤,滤液中含有KOH、KCl、KClO3、K2MnO4,然后向溶液中通入CO2并调节溶液的pH至10-11,KOH转化为K2CO3,根据溶解性表知,K2MnO4溶解度最小,趁热过滤,得到K2MnO4固体,然后抽滤、洗涤烘干得到K2MnO4粗晶体,
(1)步骤①熔融固体需要在坩埚中进行,且熔融的物质和坩埚成分不反应;
(2)综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂具有酸性,且和锰酸钾、高锰酸钾都不反应;
(3)如果溶液中存在K2MnO4,通入CO2会产生沉淀;K2MnO4溶液显绿色,KMnO4溶液紫红色;
(4)当溶液pH值达10~11时,停止通CO2;若CO2过多,二氧化碳和碳酸钾反应生成碳酸氢钾;
(5)加热时高锰酸钾会分解生成锰酸钾;
(6)①滴定过程中草酸具有还原性,可以还原高锰酸钾溶液为Mn2+,草酸被氧化为二氧化碳,结合电荷守恒、原子守恒配平书写离子方程式;
②配制100ml溶液需要溶解、洗涤、转移、定容、摇匀等步骤,依据操作步骤选择需要的玻璃仪器;
③量取KMnO4待测液10.00ml,若该滴定管用蒸馏水洗净后未润洗,导致高锰酸钾溶液浓度减小;
④滴定终点是利用高锰酸钾溶液颜色变化判断,当滴入最后一滴草酸溶液溶液紫红色变化为无色且半分钟不再变化;
⑤2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
2 5
n c mol/L×V×10-3L
n=$\frac{2}{5}$cV×10-3mol,
100ml溶液中含KMnO4物质的量n=$\frac{2}{5}$cV×10-3mol×$\frac{100}{10}$=$\frac{2}{5}$cV×10-2mol,
据此计算高锰酸钾的质量分数.
解答 解:根据流程图知,①中发生反应3MnO2+KClO3+6KOH$\frac{\underline{\;熔化\;}}{\;}$3K2MnO4+KCl+3H2O,冷却后捣碎加入蒸馏水并煮沸,然后过滤,滤液中含有KOH、KCl、KClO3、K2MnO4,然后向溶液中通入CO2并调节溶液的pH至10-11,KOH转化为K2CO3,根据溶解性表知,K2MnO4溶解度最小,趁热过滤,得到K2MnO4固体,然后抽滤、洗涤烘干得到K2MnO4粗晶体,
(1)步骤①熔融固体需要在坩埚中进行,且熔融的物质和坩埚成分不反应,步骤①中含有KOH碱性物质,KOH能和SiO2反应生成硅酸钾,所以应该用铁坩埚熔融,故选D,
故答案为:D;
(2)综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂具有酸性,且和锰酸钾、高锰酸钾都不反应,稀盐酸和二氧化锰都能被酸性高锰酸钾溶液氧化,所以不能选取,硫酸酸性太强,可以选取醋酸,故选B,
故答案为:B;
(3)如果溶液中存在K2MnO4,通入CO2会产生沉淀,且K2MnO4溶液显绿色,KMnO4溶液紫红色,所以可以通过通入二氧化碳是否产生沉淀及溶液在滤纸上的颜色判断,故选B,
故答案为:B;
(4)当溶液pH值达10~11时,停止通CO2;若CO2过多,二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低,
故答案为:二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低;
(5)如果温度过低,烘干时间过长,如果温度过高,会导致高锰酸钾分解,产率降低,
故答案为:如果温度过低,烘干时间过长,如果温度过高,高锰酸钾受热分解;
(6)①滴定过程中草酸具有还原性,可以还原高锰酸钾溶液为Mn2+,草酸被氧化为二氧化碳,结合电荷守恒、原子守恒配平书写离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
②配制100mL该溶液时,配制过程中除玻璃棒和烧杯外还需要用到的玻璃仪器有100mL容量瓶、胶头滴管,
故答案为:100mL容量瓶、胶头滴管;
③若该滴定管用蒸馏水洗净后未润洗,会稀释溶液浓度,则最终测定结果将偏小,
故答案为:偏小;
④滴定终点是利用高锰酸钾溶液颜色变化判断,当滴入最后一滴草酸溶液溶液紫红色变化为无色且半分钟不再变化,说明反应达到终点,
故答案为:溶液由红色变无色;
⑤称量w g KMnO4粗产品配制成100ml待测溶液,量取KMnO4待测液10.00ml,经测定每滴定10.00ml待测液平均消耗c mol/L草酸标准液Vml,
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
2 5
n c mol/L×V×10-3L
n=$\frac{2}{5}$cV×10-3mol,
100ml溶液中含KMnO4物质的量n=$\frac{2}{5}$cV×10-3mol×$\frac{100}{10}$=$\frac{2}{5}$cV×10-2mol,
样品纯度的表达式=$\frac{\frac{2}{5}cV×1{0}^{-2}mol×Mg/mol}{wg}$×100%=$\frac{CVM}{250W}$×100%
故答案为:$\frac{CVM}{250W}$×100%.
点评 本题考查制备实验方案设计,为高频考点,侧重考查学生分析判断及计算、获取信息利用信息解答问题及综合应用能力,涉及仪器的选取、物质检验、物质的量的计算等知识点,注意物质性质的特殊性、容量瓶选取方法和流程分析,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{22}^{46}$Ti比${\;}_{22}^{47}$Ti少1个质子 | |
| B. | ${\;}_{22}^{46}$Ti和${\;}_{22}^{47}$Ti的化学性质相同 | |
| C. | ${\;}_{22}^{46}$Ti的相对原子质量是46 | |
| D. | ${\;}_{22}^{47}$Ti的原子序数为47 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下表中实线表示目前元素周期表七个周期的部分边界. ①~⑧八种元素在周期表中的相对位置如下:
下表中实线表示目前元素周期表七个周期的部分边界. ①~⑧八种元素在周期表中的相对位置如下:
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COONa溶液中加入少量KCl固体后的碱性溶液一定有:c(Na+)-c(CH3COO-)=c(OH-)-c(H+) | |
| B. | 同浓度的CH3COONa和NaClO混合液中各离子浓度大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 常温下,在10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≤20mL(忽略溶液体积变化) | |
| D. | 某温度下,pH=11的NH3•H2O和pH=1的盐酸等体积混合后恰好完全反应,反应后的溶液中NH4+、NH3•H2O与NH3三种微粒的平衡浓度之和为0.05 mol•L-1(忽略溶液体积变化) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |||
| Y | Z | W | |
| T |
| A. | 化合物YX2、ZX2化学键类型和晶体类型均相同 | |
| B. | Z、W、T三种元素最高价氧化物的水化物的酸性依次增强 | |
| C. | 五种元素中,只有T是金属元素 | |
| D. | Mg在一定条件下可以和YX2发生反应生成Y单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | 双酚A属于酚类 | B. | 双酚A属于芳香族化合物 | ||
| C. | 双酚A与苯酚互为同系物 | D. | 双酚A不属于醇类 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

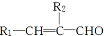 +H2O
+H2O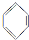 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$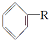 +HCl
+HCl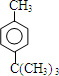 ;
;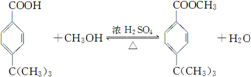 ;
;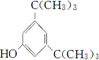 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com