
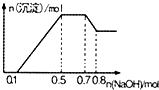
 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、Cl-中的几种,若向溶液中加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、Cl-中的几种,若向溶液中加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )| A. | 溶液中的阳离子只有H+、Mg2+、Al3+ | |
| B. | 无法确定溶液中是否含有CO32-、SO42-和Cl- | |
| C. | 溶液中n(NH4+)=0.2mol | |
| D. | n(H+):n(Al3+):n(Mg2+)=1:1:1 |
分析 向溶液中加入NaOH溶液,开始没有沉淀生成,而后有产生白色沉淀,说明溶液中H+,因此溶液显酸性,则CO32-不能大量共存,由于得到白色沉淀,则不存在Fe3+离子,加入足量的氢氧化钠,最终沉淀部分溶解,则溶液中一定含有Mg2+、Al3+,又因为当沉淀达到最大值时,继续加入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+,由于溶液中还必须存在阴离子,SO42-、Cl-中至少含有一种,结合图象中各阶段消耗的氢氧化钠,计算溶液中n(H+)、n(Mg2+)、n(Al3+)、n(NH4+).
解答 解:向溶液中加入NaOH溶液,开始没有沉淀生成,而后有产生白色沉淀,说明溶液中H+,因此溶液显酸性,则CO32-不能大量共存,由于得到白色沉淀,则不存在Fe3+离子,加入足量的氢氧化钠,最终沉淀部分溶解,则溶液中一定含有Mg2+、Al3+,又因为当沉淀达到最大值时,继续加入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+,由于溶液中还必须存在阴离子,SO42-、Cl-中至少含有一种.
由图象可知,第一阶段为氢离子与氢氧化钠反应,消耗氢氧化钠为0.1mol,则n(H+)=0.1mol;
第三阶段为铵根离子与氢氧化钠反应,消耗氢氧化钠为0.7mol-0.5mol=0.2mol,则n(NH4+)=0.2mol;
最后阶段为氢氧化钠溶解氢氧化铝,消耗氢氧化钠0.8mol-0.7mol=0.1mol,则n[Al(OH)3]=0.1mol,根据铝元素守恒可知n(Al3+)=0.1mol;
第二阶段为氢氧化钠沉淀镁离子、铝离子,共消耗氢氧化钠为0.5mol-0.1mol=0.4mol,则n(Mg2+)=(0.4mol-0.1mol×3)÷2=0.05mol.
A.由上述分析可知,溶液中的阳离子只有H+、Mg2+、Al3+、NH4+,故A错误;
B.由上述分析可知,溶液中一定不含CO32-,故B错误;
C.由上述分析可知,溶液中n(NH4+)=0.2mol,故C正确;
D.由上述分析可知,溶液中n(H+):n(Al3+):n(Mg2+)=0.1mol:0.1mol:0.05mol=2:2:1,故D错误,
故选C.
点评 本题考查离子共存、反应图象识别以及离子反应有关计算等,是高考中的常见题型,对学生的综合能力提出了更高的要求,有利于培养学生的逻辑思维能力和发散思维能力,难度较大.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ③⑥ | C. | ②④ | D. | ①③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3+3H2O═Al(OH)3+3HCl | |
| B. | Na2CO3+2H2O?H2CO3+2NaOH | |
| C. | 碳酸氢钠溶液:HCO3-+H2O?H2CO3+OH-- | |
| D. | NH4Cl溶于D2O中:NH4++D2O?NH3•D2O+H+. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA | |
| B. | 22.4LHCl中的分子数为NA | |
| C. | Na2O2与水充分作用生成0.1molO2时转移的电子数为0.2NA | |
| D. | 0.1mol铁与足量盐酸反应转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将16.8g碳酸氢钠与11.7g过氧化钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,得到残余固体X.
将16.8g碳酸氢钠与11.7g过氧化钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,得到残余固体X.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应的还原产物是N2 | |
| B. | 消耗1 mol氧化剂,转移电子3 mol | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 反应后溶液的酸性明显增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
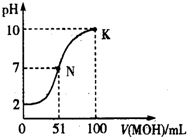 常温下,将浓度为0.02mol•L-1的MOH溶液逐滴滴入100mL 0.01mol•L-1HA溶液中,溶液pH随MOH溶液体积变化如图所示,若忽略溶液混合时体积的变化,下列叙述正确的是( )
常温下,将浓度为0.02mol•L-1的MOH溶液逐滴滴入100mL 0.01mol•L-1HA溶液中,溶液pH随MOH溶液体积变化如图所示,若忽略溶液混合时体积的变化,下列叙述正确的是( )| A. | 忽略温度影响,滴入MOH溶液过程中,水的电离程度不变 | |
| B. | HA为弱酸,MOH为强碱 | |
| C. | N点MOH过量,故溶液中c(M+)>c(A-) | |
| D. | K点的c(MOH)+c(M+)=0.01 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com