考点:热化学方程式,化学平衡的影响因素,化学平衡状态的判断,等效平衡,化学平衡的计算
专题:化学平衡专题
分析:(1)依据燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量书写热化学方程式;
(2)N
2(g)+3H
2(g)═2NH
3(g)△H=-92.4KJ/mol
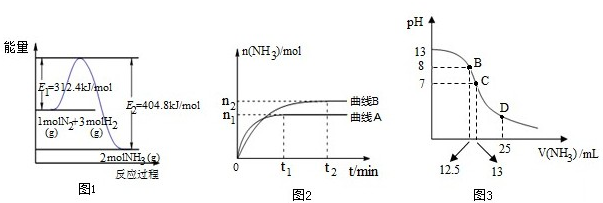
A.依据图象分析,反应焓变△H=312.4KJ/mol-404.8KJ/mol=-92.4kJ/mol;
B.使用催化剂改变反应速率降低反应的活化能;
C.温度越低平衡正向进行,工业生产中反应速率慢,生成效率和经济效益低;
D.图2是不同压强下反应体系中氨的物质的量与反应时间关系,依据先拐先平压强大,结合氨气物质的量分析;
E.图2是不同温度下反应体系中氨的物质的量与反应时间关系先拐先平温度高,结合氨气物质的量分析;
F.该反应温度不变,反应的平衡常数随温度变化分析;
G.在曲线A条件下,反应从开始到平衡,计算氨气的反应速率,依据反应速率之比等于系数之比,得到消耗N
2的平均速率=
;
(3)反应达到平衡状态的是正逆反应速率相同,个组分含量保持不变分析,由此衍生的一些物理量也不变,以此进行判断;
(4)依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算平衡常数;起始量为amol N
2、bmol H
2、cmol NH
3(a、b、c均不为零),欲使平衡混合物中各物质的质量与原平衡相同,满足转化为起始量“等量等效”分析;
(5)图象分析恰好反应时消耗HN
3的体积为12.5ml,此时溶液PH为8显碱性,说明HN
3为弱酸,D点加入25mlHN
3溶液得到等浓度的NaN
3和 HN
3溶液,溶液PH小于7显酸性,说明酸电离大于水解;
解答:
解:(1)H
2(g)的燃烧热为285.8kJ/mol,表示NH
3(g)燃烧热的热化学反应方程式为:NH
3(g)+
O
2(g)=
N
2(g)+
H
2O(l)△H=-382.5KJ/mol;
故答案为:NH
3(g)+
O
2(g)=
N
2(g)+
H
2O(l)△H=-382.5KJ/mol;
(2)A.依据图象分析,反应焓变△H=312.4KJ/mol-404.8KJ/mol=-92.4kJ/mol,故A正确;
B.使用催化剂改变反应速率降低反应的活化能,E
1减小,故B错误;
C.为了提高转化率,反应是放热反应,温度越低平衡正向进行,工业生产中反应速率慢,生成效率和经济效益低,故C错误;
D.图2是不同压强下反应体系中氨的物质的量与反应时间关系,依据先拐先平压强大,p
A>p
B ,压强越大氨气物质的量增大,故D错误
E.图2是不同温度下反应体系中氨的物质的量与反应时间关系先拐先平温度高,T
A>T
B,故E正确;
F.反应的平衡常数随温度变化,该反应温度不变,平衡常数不变,压强改变不影响平衡常数,图象中影响因素依据DE分析是温度改变,T
A>T
B,温度越高平衡逆向进行,平衡常数K
A<K
B,故F正确;
G.在曲线A条件下,反应从开始到平衡,V(NH
3)=
=
mol/L?min,反应速率之比等于系数之比,消耗N
2的平均速率=
V(NH
3)=
mol?L-1?min-1,故G正确;
故答案为:AEFG;
(3)该反应达到平衡状态的标志是正逆反应速率相同,个组分含量保持不变;
A.衡时各物质的物质的量的多少取决于起始量与转化的程度,不能作为判断达到平衡的依据,容器内N
2、H
2、NH
3的浓度之比为1:3:2,故A错误;
B.反应速率之比等于系数之比,3v(N
2)
正=v(H
2)
正,3v(N
2)
正=v(H
2)
逆,v(H
2)
正=v(H
2)
逆,说明反应达到平衡,v(N
2)
正=v(H
2)
逆,不能说明反应达到平衡状态,故B错误;
C.N
2(g)+3H
2(g)═2NH
3(g),反应前后气体体积变化,容器内压强保持不变说明反应达到平衡状态,故C正确;
D.反应前后质量不变,体积不变,混合气体的密度在反应过程中和平衡状态下相同,所以混合气体的密度保持不变不能说明反应达到平衡状态,故D错误;
故答案为:C;
(4)一定温度下,向一个容积为2L的密闭容器中通入2molN
2和7molH
2,则依据平衡三段式列式计算,设氮气消耗物质的量为x;
N
2(g)+3H
2(g)═2NH
3(g),
起始量(mol/L) 2 7 0
变化量(mol/L) x 3x 2x
平衡量(mol/L) 2-x 7-3x 2x
达到平衡时测得容器内的压强为起始时的
倍,气体物质的量之比等于压强之比;2-x+7-3x+2x=
(2+7)
x=1
平衡常数K=
=0.25;
起始量为amol N
2、bmol H
2、cmol NH
3(a、b、c均不为零),欲使平衡混合物中各物质的质量与原平衡相同,满足转化为起始量“等量等效”;
N
2(g)+3H
2(g)═2NH
3(g),
起始量(mol/L) a b c
转化量 a+
b+
0
则a+
=2 b+
=7;
故答案为:0.25;a+
=2 b+
=7;
(5)①图象分析氢氧化钠溶液和HN
3溶液恰好反应时消耗HN
3的体积为12.5ml,此时溶液PH为8显碱性,说明HN
3为弱酸;
故答案为:弱;
②D点加入25mlHN
3溶液得到等浓度的NaN
3和 HN
3溶液,溶液PH小于7显酸性,说明酸电离大于水解,溶液中离子浓度大小为C(N
3-)>C(Na
+)>C(H
+)>C(OH
-);
故答案为:C(N
3-)>C(Na
+)>C(H
+)>C(OH
-);
点评:本题考查了热化学方程式书写方法,化学平衡影响因素分析判断,平衡常数、反应速率计算应用,等效平衡状态的分析方法,盐类水解的应用,掌握基础是关键,题目难度中等.



 聚合得
聚合得 处开环聚合
处开环聚合 (此聚合物用作表面活性剂),则开环
(此聚合物用作表面活性剂),则开环  聚合得
聚合得
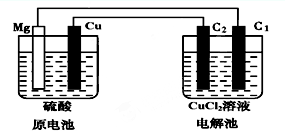 某研究性学习小组的课题为“Mg-Cu硫酸原电池电解CuCl2溶液的研究”,他们的研究装置如图所示(C1、C2均为碳棒),按要求填写下列空格.
某研究性学习小组的课题为“Mg-Cu硫酸原电池电解CuCl2溶液的研究”,他们的研究装置如图所示(C1、C2均为碳棒),按要求填写下列空格.