
【题目】A、B、C、D四种化合物其焰色反应均为紫色,A、B、C和盐酸反应均得到D,将固体C加热可得到A,若向A的溶液中通入一种无色无味气体,又可制得C,若B与C的溶液混合可制得A,试推断:
(1)A是 , B是 , C是 , D是 .
(2)完成有关化学方程式:C→A , A→C , B+C→A .
【答案】
(1)碳酸钾;氢氧化钾;碳酸氢钾;氯化钾
(2)2KHCO3 ![]() K2CO3+CO2↑+H2O;K2CO3+CO2+H2O═2KHCO3;KOH+KHCO3═K2CO3+H2O
K2CO3+CO2↑+H2O;K2CO3+CO2+H2O═2KHCO3;KOH+KHCO3═K2CO3+H2O
【解析】解:化合物A、B、C、D焰色反应均为紫色,说明都含有K元素;A、B、C和盐酸反应均得到D,则D为KCl,将固体C加热可得到A,若在A的溶液中通入一种无色无味气体,又可制得C,可以判断,无色无味的气体是CO2 , A为K2CO3 , C为KHCO3 , 若B与C的溶液混合可制得A,则B为KOH.(1)由上述分析可知,A是碳酸钾,B是氢氧化钾,C是碳酸氢钾,D是氯化钾,所以答案是:碳酸钾;氢氧化钾;碳酸氢钾;氯化钾;(2)C→A的反应方程式为:2KHCO3 ![]() K2CO3+CO2↑+H2O,A→C的反应方程式为:K2CO3+CO2+H2O═2KHCO3 , B+C→A的反应方程式为:KOH+KHCO3═K2CO3+H2O,所以答案是:2KHCO3
K2CO3+CO2↑+H2O,A→C的反应方程式为:K2CO3+CO2+H2O═2KHCO3 , B+C→A的反应方程式为:KOH+KHCO3═K2CO3+H2O,所以答案是:2KHCO3 ![]() K2CO3+CO2↑+H2O;K2CO3+CO2+H2O═2KHCO3;KOH+KHCO3═K2CO3+H2O.
K2CO3+CO2↑+H2O;K2CO3+CO2+H2O═2KHCO3;KOH+KHCO3═K2CO3+H2O.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某科研小组利用如下反应消除NO和CO的污染;2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=xkJ/mol。T℃时,在容积为2L的恒容密闭容器中充入2molNO和2molCO,保持温度不变,5min时达到平衡状态,此时c(N2)=0.4mol/L。下列说法中不正确的是 ( )
N2(g)+2CO2(g) △H=xkJ/mol。T℃时,在容积为2L的恒容密闭容器中充入2molNO和2molCO,保持温度不变,5min时达到平衡状态,此时c(N2)=0.4mol/L。下列说法中不正确的是 ( )
A. x<0
B. α(NO)=80%
C. 0~5min内,V(CO)=0.16mol/(L·min)
D. 保持温度不变,若再向上述平衡体系中充入2molNO和2molCO,重新达平衡时,c(N2)=0.8mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将HC1气体通入到1L浓度均为0.1mol/L的NaA和NaB的混合溶液中,混合溶液的pH与离子浓度变化的关系如图所示(忽略溶液体积的变化)。下列叙述不正确的是
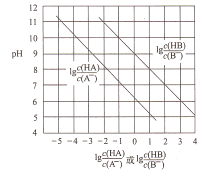
A. Ka(HB)的数量级为10-9
B. 酸性的强弱顺序为HCl>HA>HB
C. 当通入0.1molHC1气体时,c(B-)>c(A-)
D. 当混合溶液呈中性时,c(Na+)=c(Cl-)+c(A-)+c(B-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI═2KCl+I2 . 请回答下列问题: 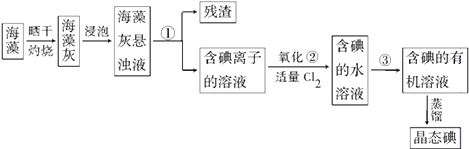
(1)指出提取碘的过程中有关实验操作①、③的名称:; .
(2)在3mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象是 . (注:如图试管中深色区为紫红色溶液) 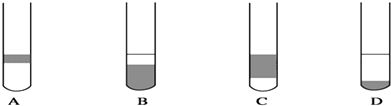
(3)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出如图实验装置中的错误之处.(加热装置烧杯下已垫石棉网) 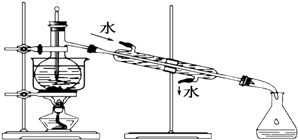
①;
② .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)俗称蚁醛,是一种重要的有机原料。
I.利用甲醇(CH3OH)制备甲醛
脱氢法:CH3OH(g)=HCHO(g)+H2(g) △H1 = +92.09kJ/mol
氧化法:CH3OH(g) +1/2O2(g)=HCHO(g)+H2O(g) △H2
(1)已知:2H2(g)+O2(g)=2H2O(g) △H3=-483.64 kJ/mol,则△H2=_______。
(2)与脱氢法相比,氧化法在热力学上趋势较大,其原因为_______________。
(3)图1为甲醇制备甲醛反应的lg K(K为平衡常数)随温度(T)的变化曲线。曲线____(填“a”或“b”)对应脱氢法,判断依据为_________________。

II.甲醛的用途
(4)将甲醛水溶液与氨水混合蒸发可制得乌洛托品(结构简式如图2),该物质在医药等工业中有广泛用途。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为_______。
(5)将甲醛水溶液与硫酸镍(NiSO4)混合,可用于化学镀镍。若反应过程中有CO2产生,则该反应的离子方程式为____________________。
Ⅲ.甲醛的检测
(6)室内甲醛超标会危害人体健康,通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图3所示,则b极的电极反应式为_________,当电路中转移4×10-4 mol电子时,传感器内参加反应的HCHO为_______mg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是以有机物A合成聚酯类高分子化合物F的路线:

已知:
回答下列问题:
(1)A生成B的反应类型为_____,C中的官能团名称为________。
(2)D与NaOH水溶液反应的化学方程式为________。
(3)①E生成F的化学方程式为________。
②若F的平均相对分子质量为20000,则其平均聚合度为________。(填字母)
A.54 B.108 C.119 D.133
(4)E在一定条件下还可以合成含有六元环状结构的G。G的结构简式为________。
(5)满足下列条件的C的同分异构体有_____种。(不考虑立体异构)
①含有1个六元碳环且环上相邻4个碳原子上各连有一个取代基
②1mol该物质与斐林试剂反应产生2mol砖红色沉淀
(6)写出用![]() 为原料制各化合物
为原料制各化合物 的合成路线______。(其他试剂任选)
的合成路线______。(其他试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼是动植物所必须的微量元素,其单质和化合物广泛应用于冶金、机械、化工、核工业、医药、农业等部门。利用硼镁矿(主要成分为Mg2B2O3·5H2O)制取制硼酸、金属镁及粗硼的工艺流程图如下:
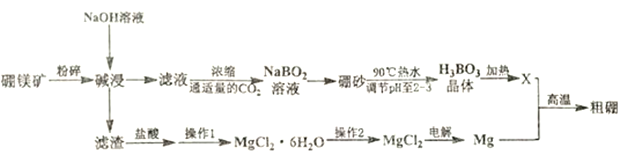
已知:①硼砂为Na2B4O7·10H2O
②硼酸(H3BO3)是一种可溶于水的一元弱酸,与过量的NaOH反应生成Na[B(OH)4]
③硼酸在不同温度下的溶解度:
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
溶解度(g/100g水) | 3 | 3 | 5 | 7 | 9 | 11 | 15 | 18 | 23 | 29 |
(1)粉碎硼铁矿的目的是:______________;Mg2B2O5·H2O中B的化合价为:______价。
(2)滤渣的主要成分是: ________
(3)硼酸的电子式: ________;写出硼酸在水中电离的方程式: ________________;
(4)X为硼酸晶体加热完全脱水后的产物,其与Mg反应制取粗硼的化学方程式为: ________;
(5)硼砂溶于90℃热水后,常用稀硫酸调pH至2~3(酸性)制取HBO3晶体,该反应的离子方程式为: ________________;从上述溶液中获得H3BO3晶体的操作: ________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有下列4种离子的溶液中加入烧碱固体(溶液体积变化可忽略),能引起离子浓度减小的是( )
A. NO3- B. Ba2+ C. OH- D. Cu2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com