
【题目】某浓度的氨水中存在下列平衡:NH3·H2O![]() NH4++OH-,若想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
NH4++OH-,若想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
A. 适当升高温度B. 加入NaCl固体C. 加入少量盐酸D. 通入NH3
科目:高中化学 来源: 题型:
【题目】四种短周期元素A、B、C、D,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:![]() ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期除稀有气体外半径最大的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)A为__________(写出元素符号),电子排布式是_____________;
(2)C为________(写出元素符号),价电子排布式是________________;
(3)D的电子排布图是__________;
(4)E的原子结构示意图是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年,我国科学家研发出一种新型的锌碘单液流电池,已知M为阴离子交换膜,其原理如图所示。下列说法不正确的是
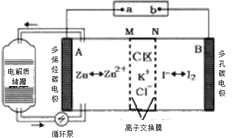
A.放电时A电极反应式为:Zn-2e﹣= Zn2+
B.充电时,B极与外接电源正极相连
C.放电时电解质储罐中离子浓度增大
D.放电时当A极减少65g时,C区Cl﹣增加2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
已知:C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+![]() O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) ΔH3=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH3=-283.0 kJ·mol-1
则煤气化主要反应C(s)+H2O(g)=CO(g)+H2(g)的ΔH=____________________。
Ⅱ.为了减少CO的排放,某环境研究小组以CO和H2为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。
(1)如图所示能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母),其判断理由是____________。

(2)在一定温度下,向2.0 L固定容积的密闭容器中充入2 mol H2和1 mol CO,经过一段时间后,反应4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
时间/min | 0 | 20 | 40 | 80 | 100 |
n(H2)/mol | 2.0 | 1.4 | 0.85 | 0.4 | — |
n(CO)/mol | 1.0 | — | 0.425 | 0.2 | 0.2 |
n(CH3OCH3)/mol | 0 | 0.15 | — | — | 0.4 |
n(H2O)/mol | 0 | 0.15 | 0.2875 | 0.4 | 0.4 |
①0~20 min的平均反应速率v(CO)=__________________mol·L-1·min-1;
②达到平衡时,H2的转化率为__________________;
③在上述温度下,该反应的平衡常数K=______________________;
④能表明该反应达到平衡状态的是________(填序号);
A CO的转化率等于H2O的产率 B 混合气体的平均相对分子质量不变
C v(CO)与v(H2)的比值不变 D 混合气体的密度不变
⑤在上述温度下,向平衡后的2 L容器中再充入0.4 mol H2和0.4 mol CH3OCH3(g),则化学平衡________移动(填“向左”“向右”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
G是功能高分子材料。以甲苯为原料合成G的一种流程如下(部分条件和产物略去)。
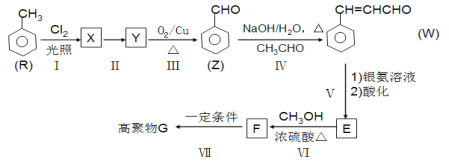
回答下列问题:
(1)W中官能团名称是:_______________________;反应Ⅰ的类型是_________________。
(2)反应Ⅱ的试剂和条件是____________、_______________;Z的名称是______________。
(3)写出F→G的化学方程式:_________________。
(4)T是E的同分异构体,T的苯环上有3个互不相同的取代基,T的结构有______种。
(5)W分子中最多有______个原子共平面。
(6)以乙醇为原料,经过三步合成正丁醇。参照上述流程图设计合成路线。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)写出下列仪器的名称
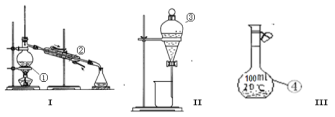
② _____________③____________④________________
(2)分离出碘水中的碘应先选择装置____________(填I、II、III) 进行操作;
该分离提纯的方法叫_____________ ;
进行该操作,需加一试剂,在选择试剂时,下列性质你认为哪些性质是必需的:____________(填序号)
①与碘水不反应 ②I2在其中溶解程度大于在水中的溶解度 ③与水不相容 ④密度要比水小
如果选择苯C6H6(是一种密度比水小的有机溶剂)作这种试剂,现象是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() —NMR(核磁共振)、
—NMR(核磁共振)、![]() —NMR可用于测定蛋白质、核酸等生物大分子的空间结构,瑞士科学家库尔特、维特里希等人为此获得诺贝尔化学奖。下列有关
—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,瑞士科学家库尔特、维特里希等人为此获得诺贝尔化学奖。下列有关![]() 、
、![]() 的叙述正确的是( )
的叙述正确的是( )
A. ![]() 与
与![]() 互为同位素B.
互为同位素B. ![]() 与C60互为同素异形体
与C60互为同素异形体
C. ![]() 、
、![]() 具有相同的中子数D.
具有相同的中子数D. ![]() 的核外电子数与中子数相同
的核外电子数与中子数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,它可以发生反应的类型有( )
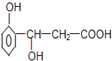
①加成 ②消去 ③水解 ④酯化 ⑤氧化 ⑥加聚
A. ①②③④B. ①②④⑤
C. ①②⑤⑥D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1 NH4Cl溶液中,不断加入固体NaOH后,NH![]() 与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
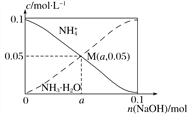
A. 在M点时,n(OH-)-n(H+)=(a-0.05) mol
B. 随着NaOH的加入,![]() 不断增大
不断增大
C. M点溶液中水的电离程度比原溶液小
D. 当n(NaOH)=0.1 mol时,c(OH-)>c(Cl-)-c(NH3·H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com