
【题目】实验室常下图装置进行铜跟浓硫酸反应等一系列实验。请回答下列问题
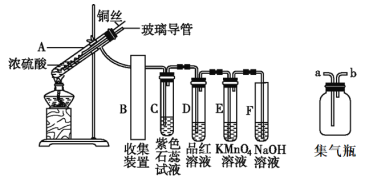
(1)装置B就是右上图的集气瓶,则装置A的导管应连接集气瓶的____(填“a”或“b”)进口;
(2)用装置A制备SO2的优点主要是_________________________。(任答一条即可);
(3)装置A中的反应方程式为______________________________________________;
(4)装置C中的现象是________________;反应结束后加热D中溶液,现象是___________;
(5)装置E中出现的现象可以说明SO2具有__________性;
(6)装置F中的反应的离子方程式为____________________________________________;
【答案】a 可以控制反应的发生与停止、可以防止倒吸 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 溶液变红 溶液恢复红色 还原性 SO2+2OH-=SO32-+H2O
CuSO4+SO2↑+2H2O 溶液变红 溶液恢复红色 还原性 SO2+2OH-=SO32-+H2O
【解析】
(1)根据二氧化硫的密度大于空气分析解答;
(2)依据装置特点解答;
(3)在加热的条件下铜与浓硫酸反应生成二氧化硫、硫酸铜和水;
(4)根据二氧化硫溶于水生成亚硫酸分析;根据二氧化硫的漂白特点分析;
(5)根据高锰酸钾溶液具有强氧化性解答;
(6)根据二氧化硫是酸性氧化物能与氢氧化钠溶液反应解答。
(1)由于二氧化硫的密度大于空气,因此可以用向上排空气法收集二氧化硫,则装置A的导管应连接集气瓶的a进口;
(2)由于装置中铜丝是可以抽出的,因此用装置A制备SO2的优点主要是可以控制反应的发生与停止、可以防止倒吸;
(3)在加热的条件下铜与浓硫酸反应生成二氧化硫、硫酸铜和水,根据原子守恒可知装置A中的反应的方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(4)二氧化硫溶于水生成亚硫酸,亚硫酸是二元酸,溶液显酸性,则装置C中紫色的石蕊试液变红;二氧化硫能使品红溶液褪色,但二氧化硫的漂白是不稳定的,因此反应结束后加热D中溶液,现象是溶液恢复红色;
(5)高锰酸钾溶液具有强氧化性,二氧化硫通入高锰酸钾溶液中溶液褪色,说明高锰酸钾被二氧化硫还原,因此装置E中出现的现象可以说明SO2具有还原性;
(6)二氧化硫是酸性氧化物,能与氢氧化钠溶液反应生成亚硫酸钠和水,则装置F中反应的离子方程式为SO2+2OH-=SO32-+H2O。


科目:高中化学 来源: 题型:
【题目】对一定量气体体积的探究。
已知1 mol不同气体在不同条件下的体积:
化学式 | 条件 | 1 mol气体体积/L |
H2 | 0 ℃,101 kPa | 22.4 |
O2 | 0 ℃,101 kPa | 22.4 |
CO | 0 ℃,101 kPa | 22.4 |
H2 | 0 ℃,202 kPa | 11.2 |
CO2 | 0 ℃,202 kPa | 11.2 |
N2 | 273 ℃,202 kPa | 22.4 |
NH3 | 273 ℃,202 kPa | 22.4 |
(1)从上表分析得出的结论:
①1 mol任何气体,在标准状况下的体积都约为________。
②1 mol不同的气体,在不同的条件下,体积________(填“一定”“一定不”或“不一定”)相等。
(2)理论依据:相同条件下,1 mol任何气体的体积几乎相等,原因是:
①________________________________________________________________________,
②________________________________________________________________________。
(3)应用:在标准状况下,4 g O2的体积为多少升?(写出计算过程)___________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学常见物质,它们在一定条件下有如下转化关系(副产物已略去)
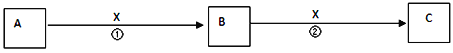
(1)若X是氧气,则A不可能是________________。
A.CB.SiC.NaD.Mg
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生了不溶于稀HNO3的白色沉淀,则B的化学式为____________。
(3)若X是氢氧化钠溶液,A、B、C均为含铝元素的化合物,则B的化学式为________。
(4)若X为盐酸,A、B、C均含碳元素,A的焰色反应呈黄色,则反应①的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是化学研究中常用的方法.下列分类方法中,正确的是
A.依据分子组成中含有氢原子的数目,将酸分为一元酸、二元酸等
B.NH4Cl组成中不含金属离子,不属于盐
C.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
D.依据组成元素的种类,将纯净物分为单质和化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A. 标准状况下,2.24 L HF含有的原子数目为0.2NA
B. 电解精练铜时,阳极质量减少6.4 g时,转移电子数一定为0.2NA
C. 常温常压下,将足量的铁粉投入含1 mol HNO3的浓硝酸中,转移的电子总数为NA
D. 将硫酸钠固体投入水中,如果n(SO![]() )=0.5 mol,则Na+数目为NA
)=0.5 mol,则Na+数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式,书写正确的是
A. Al2(SO4)3=2Al3++ 3SO42- B. AlCl3= Al3++Cl-
C. Mg(NO3)2= Mg+2+2NO3- D. KMnO4=K++Mn7++4O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列物质①NaCl晶体 ②液态SO2 ③纯醋酸④硫酸钡 ⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KNO3 ⑧NaOH溶液 ⑨氨水 请用以上物质回答下列问题(填序号)。
在上述状态下能导电的强电解质是__________________; 属于弱电解质的是________________;属于非电解质,但溶于水后的水溶液能导电的是_________________。
(2)化学平衡移动原理同样也适用于其他平衡,已知在氨水中存在下列平衡:NH3·H2O ![]() NH4++OH-。
NH4++OH-。
①向氨水中加入NH4Cl固体时,平衡____________移动,(填“向右”或“向左”),c(OH-)____(填“增大”或“减小”,下同),c(NH4+)______。
②向氨水中加入MgCl2固体时,平衡_____移动,(填“向右”或“向左”),c(OH-)____(填“增大”或“减小”,下同),c(NH4+)_________。
③升高温度,c(OH-)______(填“增大”或“减小”,下同),c(NH4+)___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com