
【题目】下列语句中隐含化学变化的是
A.燃灶液化气化液灶燃B.上海自来水来自海上
C.黄山落叶松叶落山黄D.香山红叶寺叶红山香
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品中Na2CO3的纯度(质量分数)是
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请把符合要求的化学方程式的编号填在下列空白处:
①既属于分解反应又是氧化还原反应的是________。
②属于化合反应,但不是氧化还原反应的是________。
③既属于化合反应,又是氧化还原反应的是________。
④属于分解反应,但不是氧化还原反应的是________。
⑤不属于四种基本反应类型的氧化还原反应的是________。
A.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
B.2Na+Cl2![]() 2NaCl
2NaCl
C.Zn+CuSO4===ZnSO4+Cu
D.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
E.CaO+CO2===CaCO3
F.4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)根据反应Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①还原剂是________,还原产物是________。
②氧化剂与氧化产物的物质的量比是________。
③当有2 mol HNO3参加反应时,被氧化的物质质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于四种基本反应类型,但不属于氧化还原反应的是( )
A. Fe+CuSO4═FeSO4+Cu B. CO+CuO![]() Cu+CO2
Cu+CO2
C. AgNO3+NaCl═AgCl↓+NaNO3 D. 2FeCl2+Cl2═2FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是重要的工业元素。
(1)铁元素位于周期表中的___________区,Fe的外围电子排布的轨道表示式为_____,Fe的7个能级中能量最高的是__________________。
(2)(NH4)2Fe(SO4)2·6H2O俗称摩尔盐,其中H2O的VSEPR模型名称为______________。写出一种与SO42-互为等电子体的分子的化学式__________________。
(3)金属Fe具有导电性,温度越高其导电性越____________,其原因是__________________。
(4)ZnCl2浓溶液常用于除去Fe表面的氧化物,反应可得[Zn(OH)2Cl2]2-溶液。[Zn(OH)2Cl2]2-中肯定不存在的微粒间作用力有_________________(填选项字母);
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
画出溶液中[Zn(OH)2Cl2]2-的结构式,并表示出配位键____________________。
(5)某种磁性氮化铁的结构如图所示 ,Fe为____________堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为
,Fe为____________堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为![]() ,则该化合物的化学式为_____________。 其中铁原子最近的铁原子的个数为_________________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为__________g·cm-3(用含a、c和NA的计算式表示)。
,则该化合物的化学式为_____________。 其中铁原子最近的铁原子的个数为_________________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为__________g·cm-3(用含a、c和NA的计算式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸法是在一定温度下盐酸与铝土矿、高岭土或粉煤灰等固体中的活性Al2O3发生反应制备Al2O3的工艺。氯化铝溶液可通过蒸发结晶生成结晶氯化铝,进而焙烧得到氧化铝;也可利用氯化铝在酸溶液中的溶解度随着盐酸浓度的升高而急剧降低的特点,生成氯化铝晶体,从而焙烧得到氧化铝。图1是我国某公司研发的具有自主知识产权的“一步酸溶法”工艺流程。
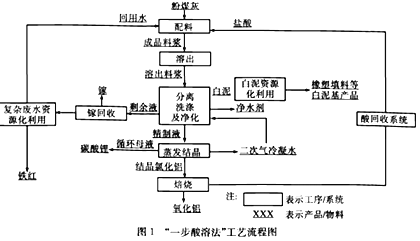
回答下列问题:
(1)“氯化铝在酸溶液中的溶解度随着盐酸浓度的升高而急剧降低”的原因是________________________________________________________(结合必要的化学方程式说明)。
(2)精制液蒸发结晶后分离出纯净结晶氯化铝的操作名称是_______,用_____洗涤。
(3)写出结晶氯化铝(AlCl3·6H2O)焙烧的化学方程式:_____________________________。
(4)工业上冶炼金属铝的方法是电解熔融的_______(填化学式),电解过程中作阳极的石墨易消耗,原因是___________________________。
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,在铝热反应中常做引发剂;e、f为常见气体单质。下列有关说法正确的是
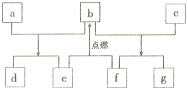
A. 简单离子的半径:Y>Z>X
B. 简单氢化物的沸点:Y>X
C. 最高价氧化物对应水化物的碱性:Z>Y
D. W、Y的氧化物所含化学键类型相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com