
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
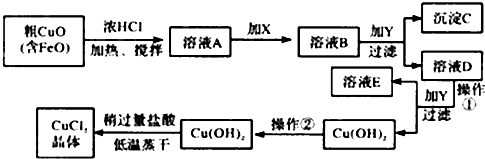
分析 粗氧化铜中含有FeO加入浓HCl加热搅拌得到溶液A,加入氧化剂把亚铁离子氧化为铁离子,加入CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3 等调节溶液PH3-4使铁离子全部沉淀,铜离子不沉淀,得到溶液D,继续加入CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3 等调节溶液PH≥6.4得到氢氧化铜沉淀,过滤得到溶液E和氢氧化铜沉淀,洗涤干燥得到的氢氧化铜就稍过量的盐酸低温蒸干得到氯化铜晶体;
(1)次氯酸钠具有氧化性,由于Fe2+沉淀时Cu2+已基本沉淀完全,所以必须先将Fe2+转变为Fe3+才能完全除去;
(2)加入氧化铜,调节溶液的PH,除去铁离子杂质;
(3)根据平衡Cu2++2H2O?Cu(OH)2+2H+进行分析.
解答 解:粗氧化铜中含有FeO加入浓HCl加热搅拌得到溶液A,加入氧化剂把亚铁离子氧化为铁离子,加入CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3 等调节溶液PH3-4使铁离子全部沉淀,铜离子不沉淀,得到溶液D,继续加入CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3 等调节溶液PH≥6.4得到氢氧化铜沉淀,过滤得到溶液E和氢氧化铜沉淀,洗涤干燥得到的氢氧化铜就稍过量的盐酸低温蒸干得到氯化铜晶体;
(1)根据表中完全沉淀时的pH范围可知,Fe2+沉淀时Cu2+已基本沉淀完全,所以必须先将Fe2+转变为Fe3+才能完全除去,所以溶液A中加入NaClO溶液,目的是氧化Fe2+ 生成Fe3+ 有利于沉淀分离,反应的离子方程式为:2H++ClO-+2 Fe2+=2 Fe3++Cl-+H2O,
故答案为:NaClO;氧化Fe2+生成Fe3+ 有利于沉淀分离;
(2)在溶液B中加CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3等调节溶液的pH使Fe3+完全沉淀,根据表中数据,Fe3+完全沉淀时PH的范围是3~4,
故答案为:Cu2(OH)2CO3;B;使Fe3+完全转变为氢氧化铁沉淀而分离Fe3+;
(3)因为溶液中存在以下平衡:Cu2++2H2O?Cu(OH)2+2H+,加入过量盐酸和低温,能使平衡逆移,防止Cu2+水解,故答案为:抑制 Cu2+水解.
点评 本题以工业上制取CuCl2的生产流程为背景,综合考查学生灵活运用元素化合物知识、氧化还原反应知识、沉淀转化、盐类水解以及实验分析等知识和技能,难度较大.


科目:高中化学 来源: 题型:填空题
 和
和 ⑤40K和40Ca ⑥
⑤40K和40Ca ⑥ 与
与 ⑦甲烷与C3H8.
⑦甲烷与C3H8.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤与结论: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可用作净水剂 | B. | 甲醛可用作食品防腐剂 | ||
| C. | 晶体硅可用于制造光导纤维 | D. | 铝制容器可长期存放酸性食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
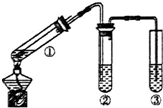
| A. | 上下移动①中铜丝可控制生成SO2的量 | |
| B. | ②中选用品红溶液验证SO2的生成 | |
| C. | ③中选用NaOH溶液吸收多余的SO2 | |
| D. | 该反应中浓硫酸表现了强氧化性和脱水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14C与14N含有相同的中子数 | |
| B. | H、D、T互为同位素 | |
| C. | 14C与C60中普通碳原子的化学性质相同 | |
| D. | 14C与12C互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XY2 | B. | X2Y3 | C. | X2Y | D. | XY |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com