
| A. | CH4的球棍模型示意图为: | B. | 乙烯的实验式为:CH2 | ||
| C. | 乙醇的结构简式:C2H5OH | D. | 2-乙基-1,3-丁二烯分子的键线式: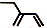 |
分析 A、根据甲烷的球棍模型与比例模型进行判断;
B、实验式是各原子的最简单的整数比;
C、结构简式能表示出分子中的成键情况;
D、键线式表示方法:碳碳键用线段来表现,画出键线式.拐点和端点表示碳原子,碳原子,H不必标出,杂原子(非碳、氢原子)不得省略,并且其上连有的氢也一般不省略.
解答 解:A、 为甲烷的比例模型,甲烷的球棍模型应该用小球和短棍表示,甲烷为正四面体结构,其正确的球棍模型为
为甲烷的比例模型,甲烷的球棍模型应该用小球和短棍表示,甲烷为正四面体结构,其正确的球棍模型为 ,故A错误;
,故A错误;
B、实验式是各原子的最简单的整数比,乙烯的分子式为C2H4,故实验式为CH2,故B正确;
C、结构简式能表示出分子中的成键情况,故乙醇的结构简式为CH3CH2OH,也可以为C2H5OH,故C正确;
D、2-乙基-1,3-丁二烯的结构简式为 ,键线式中用短线“-”表示化学键,端点、交点表示碳原子,C原子、H原子不需要标出,所以2-乙基-1,3-丁二烯的键线式为
,键线式中用短线“-”表示化学键,端点、交点表示碳原子,C原子、H原子不需要标出,所以2-乙基-1,3-丁二烯的键线式为 ,故D正确.
,故D正确.
故选A.
点评 本题考查了化学用语,注意书写结构简式时碳碳三键等官能团不能省略,理解掌握结构简式、实验式的书写是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
 “即食即热型快餐”适合外出旅行时使用.其内层是用铝箔包裹的并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )
“即食即热型快餐”适合外出旅行时使用.其内层是用铝箔包裹的并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )| A. | 氢氧化钡晶体和氯化铵晶体 | B. | 生石灰与水 | ||
| C. | 金属钠与水 | D. | 氯化钠与水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的电子式 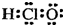 | |
| B. | S2-的结构示意图: | |
| C. | 质子数为92,中子数为143的铀原子:23592U | |
| D. | NH4I的电子式: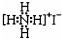 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
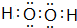 ,B的最高价氧化物的结构式:O=C=O.用电子式表示EF的形成过程
,B的最高价氧化物的结构式:O=C=O.用电子式表示EF的形成过程 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
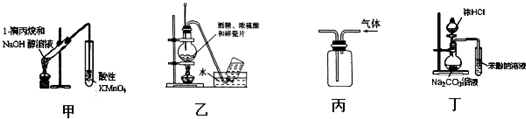
| A. | 用甲装置检验1-溴丙烷消去产物 | |
| B. | 实验室用乙装置制取乙烯 | |
| C. | 用丙装置收集甲烷气体 | |
| D. | 用丁装置证明酸性强弱:盐酸>碳酸>苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
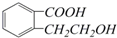 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质: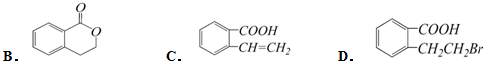
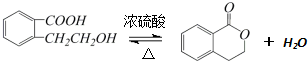 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
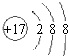
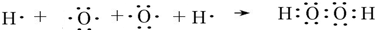
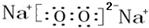 ,该化合物和B与D形成的某化合物反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,1molH发生该反应转移电子数为6.02×1023
,该化合物和B与D形成的某化合物反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,1molH发生该反应转移电子数为6.02×1023 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 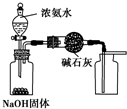 用图所示装置制取干燥纯净的氨气 | |
| B. | 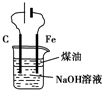 用图所示装置制备并观察氢氧化亚铁的颜色 | |
| C. | 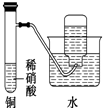 为制备并收集少量NO2气体 | |
| D. |  量取0.10 mol•L-1KOH溶液20.00 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com