
三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素原子的物质的量之比为__________.
(2)写出该反应的化学方程式____________________________________________.
若反应中生成0.2 mol HNO3,转移的电子数目为________个.
(3) 三氟化氮可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F 据题意推测 NF3,F2,NO三种气体中,氧化性由弱到强的顺序为
(4)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现.你判断该气体泄漏时的现象是___________________________________________________.
(5)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有____________________________(填化学式).
【知识点】元素化合物 B2 D4
【答案解析】
(1)1∶2 (2分)
(2)3NF3+5H2O===2NO+HNO3+9HF(2分)
0.4NA或2.408×1023个(2分)
(3) NO,NF3,F2(2分)
(4)红棕色气体、产生刺激性气味气体、产生白雾(3分)
(5)NaNO3(2分)
解析:(1)根据电子得失守恒:N(被氧化)×(5-3)=N(被还原)×(3-2),所以N(被氧化):N(被还原)=1:2,故答案为:1:2;
(2)依据化合价升降总数相等,从方程式右边着手不难配平,3NF3+5H2O═2NO+HNO3+9HF,生成0.2 mol HNO3,转移电子的数目为0.2 mol×(5-3)×NA=0.4NA,或2.408×1023,故答案为:3NF3+5H2O═2NO+HNO3+9HF;0.4NA;
(3)NF3泄漏产生NO,NO遇空气中的O2生成红棕色气体NO2,HNO3、HF气体均有刺激性气味且在空气中易形成酸雾,故答案为:产生红棕色气体、产生刺激性气味气体、产生白雾;
(4)NF3与H2O反应产生HNO3,HNO3和NaOH反应必生成NaNO3,故答案为:NaNO3.
【思路点拨】本题综合考查氧化还原反应,题目难度不大,转移把握元素化合价的判断,从化合价变化的角度解答该题.


科目:高中化学 来源: 题型:
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
| X | Y | Z | |
| ① | 氨水 | Al(OH)3 | 氢氧化钠溶液 |
| ② | KOH | SiO2 | 氢氟酸 |
| ③ | 从 | SO2 | BaCl2溶液 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①③ B.①④ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
以乙炔为主要原料可以合成聚氯乙烯、聚丙烯腈和氯丁橡胶,其制备过程如下:
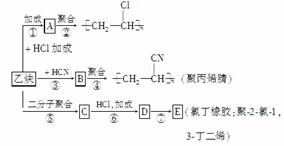
已知反应:
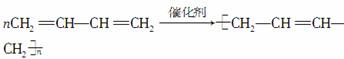
(1)试写出B和C的结构简式:B______________;C______________________。
(2)写出反应③和反应⑦的化学方程式并指明反应类型。
________________________________________________________________________
________________________________________________________________________,
________________________________________________________________________
________________________________________________________________________。
(3)若某聚丙烯腈的平均相对分子质量为26 500,则n=________。
(4)三分子乙炔在一定条件下可聚合成环状分子,该分子的结构简式可表示为
______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿伏加德罗常数的值,下列叙述正确的是( )
|
| A. | 1.00 mol•L﹣1 NaCl溶液中含有Na+的数目为NA |
|
| B. | 常温常压下,6.4 g由氧气和臭氧组成的混合物中含有的分子总数为0.2NA |
|
| C. | 标准状况下,1.12 L HCHO中C原子的数目为0.05 NA |
|
| D. | 在催化剂作用下,6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
纳米氧化铝在陶瓷、电子、生物医药等方面有广泛的用途,它可通过硫酸铝铵晶体热分解得到.制备硫酸铝铵晶体的实验流程如下: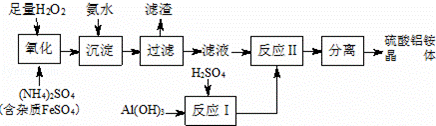
(1)H2O2氧化FeSO4的离子方程式为 2Fe2++H2O2+2H+=2Fe3++2H2O .
(2)加入氨水的目的是 Fe3+使转化为Fe(OH)3 ,其化学反应方程式为 Fe2(SO4)3+6NH3•H2O=2Fe(OH)3↓+3(NH4)2SO4 .
(3)若要保证产品的纯度,必须检验加入氨水后杂质是否除尽?其实验操作是:用试管取少量洗涤液, 加几滴KSCN溶液,若溶液不变红色 ,则说明滤渣已洗净.
(4)上述流程中,“分离”所包含的操作依次为: 蒸发浓缩 、 冷却结晶 、过滤、洗涤、干燥;请完成硫酸铝铵晶体高温分解的化学
方程式:2Al2(NH4)2(SO4)4•24H2O 2 Al2O3+ 4 NH3↑+ 8 SO3↑+ 26H2O .
2 Al2O3+ 4 NH3↑+ 8 SO3↑+ 26H2O .
(5)取4.53g 硫酸铝铵晶体加热分解,最终剩余0.51g Al2O3固体.加热过程中,固体质量随温度的变化如图所示.请计算确定400℃时(硫酸铵未分解)剩余固体成分的化学式为 (NH4)2Al2(SO4)4•H2O (不必写出计算过程).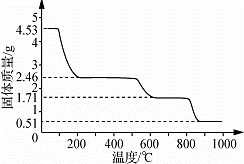
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X和Y是两种单质,X+Y→X2++Y2- ,现有下列叙述正确的是: ①X被氧化 ②X是氧化剂 ③Y2-是还原产物 ④X2+具有氧化性 ⑤Y2-具有还原性 ⑥Y单质氧化性比X2+氧化性强
A.①②③ B.①②⑥ C.①③④⑤⑥ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
.三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3。下列有关说法正确的是
A.反应中NF3是氧化剂,H2O是还原剂
B.反应中被氧化与被还原的原子物质的量之比为2:1
C.若反应中生成0.2 mol HNO3,则反应共转移0.2 mol e-
D. NF3在潮湿空气中泄漏会产生白雾、红棕色气体等现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com