
【题目】Ⅰ.下图为实验室蒸馏自来水得到少量蒸馏水的装置示意图,请根据图示回答下列问题:
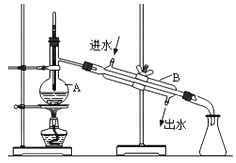
(1)装置中仪器A的名称是___________,仪器B 的名称是_____________。
(2)请指出上图中的三处明显错误中的两处:__________、__________。
Ⅱ.选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.蒸馏 B.过滤 C.结晶 D.分液
(1)分离水和煤油的混合物__________。
(2)从硝酸钾和氯化钠的混合液中获得硝酸钾__________。
(3)从加热氯酸钾制氧气后的剩余固体中获得MnO2。溶解、__________。
(4)分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物____________。
【答案】 蒸馏烧瓶 冷凝管 温度计水银球的位置错误 冷凝管中冷却水的流通方向错误(或锥形瓶不能盖塞子) D C B A
【解析】试题分析:本题考查蒸馏实验,物质分离和提纯方法的选择。
I(1)根据仪器的构造特点,仪器A的名称为蒸馏烧瓶。仪器B的名称为冷凝管。
(2)装置图中的错误有:温度计水银球的位置错误,温度计的水银球应在蒸馏烧瓶支管口处;冷凝管中冷却水的流通方向错误,冷却水应下进上出;锥形瓶不能盖塞子。
II(1)水和煤油为互不相溶的液态混合物,应用分液法分离,答案选D。
(2)KNO3的溶解度随着温度的升高明显增大,NaCl的溶解度随着温度的升高变化不明显,从KNO3和NaCl的混合液中获得KNO3,应将溶液加热浓缩、冷却结晶;答案选C。
(3)加热氯酸钾制氧气后剩余的固体为KCl和MnO2的混合物,KCl溶于水,MnO2难溶于水,所以固体溶解后过滤,答案选B。
(4)CCl4和甲苯为互相混溶沸点不同的液态混合物,分离的方法为蒸馏,答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有一块铁的“氧化物”样品,用140mL5.0mol·L-1盐酸恰好将之完全溶解,所得溶液还能吸收0.025molCl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为( )
A. Fe2O3 B. Fe3O4 C. Fe4O5 D. Fe5O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,一定互为同系物的是
A.HCHO和CH3COOHB.CH3COOH和C3H6O2
C.C2H4O2和C4H8O2D.乙苯和异丙基苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知高锰酸钾在常温下能与盐酸溶液反应,其反应的化学方程式如下:2KMnO4+16HC1=2KCl+2MnCl2+5Cl2↑+8H2O
(1)用双线桥表示电子转移的方向和数目__________________________。
(2)上述反应中氧化剂是__________,氧化产物是__________。
(3)上述反应中氧化剂与还原剂的物质的量之比为__________。
(4)若反应中转移了0.6mol 电子,产生的气体在标准状况下的体积是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯: ,下列说法正确的是( )
,下列说法正确的是( )
A. 该反应的类型为消去反应
B. 乙苯的同分异构体共有三种
C. 可用Br2/CCl4鉴别乙苯和苯乙烯
D. 乙苯和苯乙烯分子内共平面的碳原子数均为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
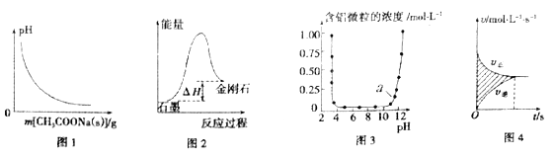
A. 图1表示向0.1mol/L CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B. 图2表示石墨转化为金刚石反应过程中的能量变化,可判断石墨比金刚石稳定
C. 图3表示Al3+与OH-反应时溶液中含铝微粒浓度变化曲线,图中a点溶液中大量存在Al3+
D. 图4表示某可逆反应的v-t曲线,图中阴影部分面积的含义是(v正-v逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】既可以用来鉴别乙烯和甲烷,又可用来除去甲烷中混有的乙烯的方法是
A.通入足量溴水中B.与酸性高锰酸钾溶液反应
C.在导管中处点燃D.一定条件下与H2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是材料科学、.生命科学、环境科学和能源科学的重要基础。下列 有关说法正确的是( )
A.合金、合成纤维、合成橡胶、塑料都是有机高分子材料
B.香烟、酒精、吗啡、海洛因都是毒品
C.二氧化硫、二氧化氮、一氧化碳都是大气污染物
D.石油、煤、天然气、氢气都是不可再生的化石燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
人类社会的发展与进步与材料的发展密不可分,而金属是人类常用的一类材料如铜、铁合金等等。
(1)基态Cu原子的价电子排布式为__________,在元素周期表中的位置为___________。
(2)Cu2O为半导体材料,可由乙醛(CH3CHO)和新制氢氧化铜反应得到。乙醛中碳原子的杂化方式有______________,乙醛分子中![]() 键与
键与![]() 键的数目之比为____________。
键的数目之比为____________。
(3)制造单晶硅太阳能电池片时,一般掺杂微量的铜、碳、硼、氮等。铜、碳、硼、氮元素的电负性由大到小的顺序是_________________。(用元素符号表示)
(4)Cu(OH)2溶于氨水形成深蓝色的[Cu(NH3)4]2+,该配合物中NH3的价层电子对互斥模型为_____________。
(5)铁在不同温度范围有不同的晶体结构,在室温下为体心立方,当温度升高到912℃,则转变为面心立方。铁的体心立方堆积和面心立方最密堆积的配位数分别为____、_____。若铁原子半径为r pm,则铁为面心立方最密堆积时的晶体密度为___________g/cm3(阿伏伽德罗常数的值用NA 表示,1pm=10-12m,写出计算式即可)。
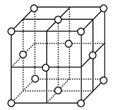
面心立方晶胞
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com