
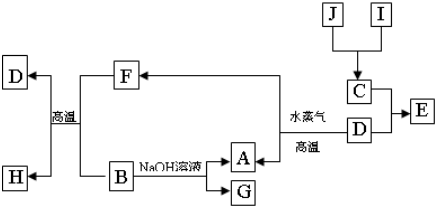
A��B��C��D�����ֶ�����Ԫ�أ����ǵ�ԭ������������������A��DԪ��ͬ���壬B��CԪ��ͬ���ڣ���A��B��C��D�е�����Ԫ�ؿ��γ�ԭ�Ӹ�����Ϊ1:1�Ķ��ֻ�����ס��ҡ�������Ϊ���е����֣����ǵ�Ԫ��������±���ʾ��

�����£�������Ϊ���壬�ܶ���С�ڿ�����������ΪҺ�壻�����ʺͶ�����Ϊ�����Ҷ�Ϊ���ӻ��������д���пհף�
��1��DԪ���γɵļ����ӵĽṹʾ��ͼΪ �������ʵĻ�ѧʽΪ �����������������������ӵĸ���֮��Ϊ ��
��2������״����5.6L��������ȫȼ�շų�������ΪQKJ����д����ʾ������ȼ���ȵ��Ȼ�ѧ����ʽ ��
��3���о����������ʾ��������ԣ�����������ˮ�еĵ��뷽��ʽΪ ��
��4��B��C����Ԫ�ذ�ԭ�Ӹ�����Ϊ1��2���γɻ������죬A��C��D����Ԫ�ذ�ԭ�Ӹ�����Ϊ1��1��1���γɻ����Z�������뼺�����ʵ���3��4��Ӧ����Һ������Ϊ ��
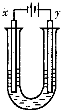
��5��ijͬѧ�����һ���Խṹ��ʽ��BA3��CA����Ϊȼ�ϵĵ�أ����øõ�ص��200mLһ��Ũ��NaCl��CuSO4�����Һ����װ�����£�

��д������ͨ���������һ���ĵ缫��Ӧʽ ��
�������Ϣ���������������������ʱ��仯�Ĺ�ϵ������ͼ��ʾ����������ѻ���ɱ�״���µ��������д����t1��ʯī�缫�ϵĵ缫��Ӧʽ ����t2ʱ������Һ��H+ Ũ��ԼΪ ��

��1��NaH 1:2
��2��CO(g)+1/2O2(g)= CO2(g) ����H=-4QkJ/mol
��3��H2O2  H++HO2-��(HO2-
H++HO2-��(HO2-  H+ +O22-���Բ�д�ڶ�������)
H+ +O22-���Բ�д�ڶ�������)
��4��Na2CO3 NaHCO3
��5���� CH3OH - 6e��+ 8OH�� = CO32��+ 6H2O �� 4OH�� - 4e�� = O2��+ 2H2O 0.1 mol/L
��������
��������������������֪��A��H��B�ǣã�C��O��D��Na����Ϊ��CO����Ϊ��H2O2����Ϊ��NaH����ΪNa2O2
.��1��Na��ԭ�ӽṹʾ��ͼΪ�� �����Ļ�ѧʽΪ��NaH��Na2O2�ĵ��뷽��ʽΪ��Na2O2=2Na++O22-.���������������ӵĸ���֮��Ϊ1:2.��2��n(CO)=V/Vm=5.6L��22.4mol/L=0.25mol.COȼ���ȵ��Ȼ�ѧ����ʽΪ�� CO(g)+1/2O2(g)= CO2(g) ����H=-4QkJ/mol ��3��H2O2����ķ���ʽ�ǣ�H2O2  H++HO2-��HO2-
H++HO2-��HO2-  H+ +O22-��4������CO2,����NaOH.�����ǰ���3:4��ϣ�������Ӧ��CO2+NaOH=NaHCO3.����3molNaHCO3,����1molNaOH�ٷ�����Ӧ��NaHCO3+NaOH=Na2CO3+H2O�����յõ�2molNaHCO3��1molNa2CO3����5�����Ǽ״�ȼ�ϵ�ء����ǵ��ء�����ͨ��״��ĵ缫�Ǹ������缫��Ӧʽ��CH3OH - 6e��+ 8OH�� = CO32��+ 6H2O�� ͨ�������ĵ缫����������������������ʯī����������������������Ӧ��������Һ�������ӵĻ�ԭ�ԣ�Cl-��OH-��SO42-.������0��t1ʱ���Cl-ʧȥ����2Cl--2e-=Cl2������t1-t2ʱ���OH-ʧȥ����:4OH--4e-=2H2O+O2������������ԭ��Ӧ��������Cu2++2e-=Cu,Ȼ����2H++2e-=H2��.n(Cl2)=0.224L��22.4L/mol=0.01mol.n(NaCl)=0.02mol.��t2ʱ�ų�������n(O2)=0.112L��22.4L/mol=0.005mol.����4OH--4e-=2H2O+O2����֪���ĵ�n(OH-)=4��0.005mol=0.02mol.n(H+)=n(OH-)=0.02mol.����c(H+)=n(H+)/V=0.02mol��0.2L=0.1mol/L
H+ +O22-��4������CO2,����NaOH.�����ǰ���3:4��ϣ�������Ӧ��CO2+NaOH=NaHCO3.����3molNaHCO3,����1molNaOH�ٷ�����Ӧ��NaHCO3+NaOH=Na2CO3+H2O�����յõ�2molNaHCO3��1molNa2CO3����5�����Ǽ״�ȼ�ϵ�ء����ǵ��ء�����ͨ��״��ĵ缫�Ǹ������缫��Ӧʽ��CH3OH - 6e��+ 8OH�� = CO32��+ 6H2O�� ͨ�������ĵ缫����������������������ʯī����������������������Ӧ��������Һ�������ӵĻ�ԭ�ԣ�Cl-��OH-��SO42-.������0��t1ʱ���Cl-ʧȥ����2Cl--2e-=Cl2������t1-t2ʱ���OH-ʧȥ����:4OH--4e-=2H2O+O2������������ԭ��Ӧ��������Cu2++2e-=Cu,Ȼ����2H++2e-=H2��.n(Cl2)=0.224L��22.4L/mol=0.01mol.n(NaCl)=0.02mol.��t2ʱ�ų�������n(O2)=0.112L��22.4L/mol=0.005mol.����4OH--4e-=2H2O+O2����֪���ĵ�n(OH-)=4��0.005mol=0.02mol.n(H+)=n(OH-)=0.02mol.����c(H+)=n(H+)/V=0.02mol��0.2L=0.1mol/L
���㣺����Ԫ�ص��ƶϡ�ԭ��ء����صȵȵ�֪ʶ��


 �������Ͽ��㱾ϵ�д�
�������Ͽ��㱾ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��B��ͬ���ڵ�һ��������С��Ԫ�أ�C��������������ɵ����ӣ�E����Χ�����Ų�ʽΪ3d64s2���ش��������⣺
��B��ͬ���ڵ�һ��������С��Ԫ�أ�C��������������ɵ����ӣ�E����Χ�����Ų�ʽΪ3d64s2���ش��������⣺

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ||
| ||
| ||
 Al��OH��3+OH-
Al��OH��3+OH- Al��OH��3+OH-
Al��OH��3+OH-�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��b��c�γɻ�����ĵ���ʽΪ
��b��c�γɻ�����ĵ���ʽΪ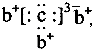 ���бȽ�����ȷ���ǣ�������
���бȽ�����ȷ���ǣ�������| A��ԭ�Ӱ뾶��a��c��d��b | B����ۺ����������c��d��a | C��ԭ��������a��d��b��c | D�����ʵ�������a��b��d��c |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com