
| A. | c(H+)≈10-9 mol/L | B. | pH=9 | C. | pH≈7 | D. | c(OH-)≈10-5mol/L |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应放出的热量始终小于92.4 kJ | |
| B. | 有无催化剂该反应放出的热量都为92.4 kJ | |
| C. | 在有催化剂存在的条件下,反应放出的热量为92.4 kJ | |
| D. | 若再充入1 mol H2,到达平衡时放出的热量应为92.4 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新装修的房子应该开窗、通风一段时间后再入住 | |
| B. | 制作家具用的固化剂等化学试剂越多越好 | |
| C. | 饮用的水越纯净越健康 | |
| D. | 旧电池已不能使用,不需要回收 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状态下,33.6L三氧化硫中含有硫原子的数目为1.5 NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5 NA | |
| C. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46 NA | |
| D. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色透明的溶液中:Cu2+、K+、SO42-、NO3- | |
| B. | 使无色酚酞试液呈红色的溶液中:Na+、K+、SO42-、CO32- | |
| C. | NH4Cl溶液中:K+、OH-、SO42-、Cl- | |
| D. | pH=1的溶液中:Na+、K+、HCO3-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
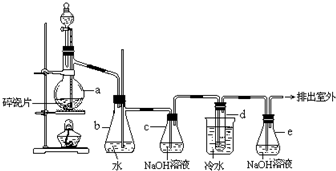
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com