
| A | NaCl═Na++Cl-; NH3•H2O?NH4++OH- | 均属于电离方程式 |
| B | Ba2++SO42-═BaSO4↓; HCO3-+OH-═CO32-+H2O | 均可表示一类反应 |
| C | 向溶液中滴加盐酸酸化过的BaCl2溶液,出现白色沉淀 | 说明该溶液中一定有SO42- |
| D | Cl2+2NaOH═NaCl+NaClO+H2O; 3S+6NaOH═2Na2S+Na2SO3+3H2O | Cl2和S在反应中既作氧化剂又作还原剂 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯化钠电离生成钠离子、氯离子;一水合氨电离生成氨根离子和氢氧根离子;
B.依据离子方程式的意义解答;
C.生成的白色沉淀可能为氯化银,原溶液中不一定含有硫酸根离子;
D.依据Cl2和S在反应中化合价变化解答.
解答 解:A.氯化钠电离生成钠离子、氯离子,电离方程式为:NaCl=Na++Cl-;一水合氨电离生成氨根离子和氢氧根离子,电离方程式为:NH3•H2O?NH4++OH-,故A正确;
B.Ba2++SO42-=BaSO4↓可以表示可溶性钡盐与可溶性硫酸盐反应生成硫酸钡沉淀的反应;HCO3-+OH-=CO32-+H2O表示可溶性碳酸氢盐与可溶性强碱反应生成可溶性碳酸盐和水,故B正确;
C.向溶液中滴加盐酸酸化过的BaCl2溶液,出现白色沉淀,该白色沉淀可能为氯化银,原溶液中可能含有银离子,不一定含有硫酸根离子,故C错误;
D.Cl2+2NaOH=NaClO+H2O,反应中氯元素化合价既升高有降低,氯气既作氧化剂又作还原剂,3S+6NaOH=2Na2S+Na2SO3+3H2O,反应中硫元素化合价既升高有降低,硫既作氧化剂又作还原剂,故D正确;
故选C.
点评 本题考查了离子方程式的书写、离子方程式表示的意义及离子的检验方法,题目难度中等,明确离子的性质、离子方程式书写的方法是解题关键,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 制取玻璃和粗硅的同时均产生CO2气体 | |
| B. | 生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应 | |
| C. | 粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法 | |
| D. | 黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.请回答下列问题.
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.请回答下列问题.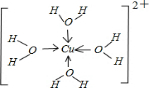 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为$\frac{7}{224}$NA | |
| B. | 1mol甲基(-CH3)所含的电子总数为10NA | |
| C. | 0.5摩1,3-丁二烯分子中含有C=C双键数为NA | |
| D. | 28g乙烯所含共用电子对数目为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com