
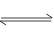 4NO(g)+6H2O(g)��10 L�ܱ������н��У�����Ӻ�ˮ���������ʵ���������0.45 mol����˷�Ӧ��ƽ������v(X)����Ӧ����������ʻ���������������ʣ��ɱ�ʾΪ
4NO(g)+6H2O(g)��10 L�ܱ������н��У�����Ӻ�ˮ���������ʵ���������0.45 mol����˷�Ӧ��ƽ������v(X)����Ӧ����������ʻ���������������ʣ��ɱ�ʾΪ| A��v(NH3)=0.010 mol��(L��s)-1 | B��v(O2)=0.001 mol��(L��s)-1 |
| C��v(NO)=0.0010 mol��(L��s)-1 | D��v(H2O)=0.045 mol��(L��s)-1 |
 ״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ͭ������ | B������ѹǿ |
| C�������������� | D�����������Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�| �¶�/�� | 700 | 900 | 830 | 1000 | 1200 |
| ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
 A(g)+B(g)��ƽ�ⳣ����ֵΪ ��
A(g)+B(g)��ƽ�ⳣ����ֵΪ ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
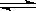 xC(g)+2D(g)��2minĩ��Ӧ�ﵽƽ��״̬��������0.8mol D�������C��Ũ��Ϊ0.4 mol��L��1������
xC(g)+2D(g)��2minĩ��Ӧ�ﵽƽ��״̬��������0.8mol D�������C��Ũ��Ϊ0.4 mol��L��1�������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 4NO(g) + 6H2O(g)��5L�ܱ������н��У�����Ӻ�NO�����ʵ���������0.3mol�����ʾ�˷�Ӧ��������ȷ����
4NO(g) + 6H2O(g)��5L�ܱ������н��У�����Ӻ�NO�����ʵ���������0.3mol�����ʾ�˷�Ӧ��������ȷ���� | A��v (O2)= 0.01mol��(L��s)�C1 | B��v (NO)= 0.005mol��(L��s)�C1 |
| C��v (H2O)= 0.003mol��(L��s)�C1 | D��v (NH3)= 0.02mol��(L��s)�C1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ǰ5min����X��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ0.5 mol����L��min��-1 |
| B��5minĩʱY��Ũ��Ϊ 2mol��L-1 |
| C����ѧ����ʽ��n = 3 |
| D��5minĩʱW�����ʵ���Ϊ1mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
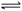 2C(g)+2D(g)���ڲ�ͬ����²�÷�Ӧ���ʣ���Ӧ�����ǣ� ��
2C(g)+2D(g)���ڲ�ͬ����²�÷�Ӧ���ʣ���Ӧ�����ǣ� ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3�ķ�Ӧ�У�����һ��ʱ���NH3��Ũ��������0.6
2NH3�ķ�Ӧ�У�����һ��ʱ���NH3��Ũ��������0.6 ,�ڴ�ʱ������NH3��ʾ�ķ�Ӧ����Ϊ0.30
,�ڴ�ʱ������NH3��ʾ�ķ�Ӧ����Ϊ0.30 ��S��1�����һ��ʱ���ǣ��� ��
��S��1�����һ��ʱ���ǣ��� ��| A��1�� | B��2�� | C��0.44�� | D��1.33�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com