
科学家利用Na2CO3溶液喷淋捕捉空气中CO2,设计技术流程如图1:

请回答下列问题:
(1)Na2CO3溶液喷成雾状的目的是____ 。
(2)在500℃的反应炉中发生反应的化学方程式为 。
(3)在整个流程中,可以循环利用的物质是 。
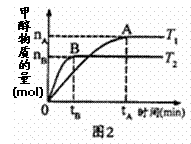 (4)为研究合成塔反应最佳条件,在10 L密闭
(4)为研究合成塔反应最佳条件,在10 L密闭
容器中发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①对于图2实验结果(注:T1、T2均大于300℃)
说法正确的是__________(填序号)。
a.向密闭容器中不断补充CO2,H2转化率增大
b.该反应在T1时的平衡常数比T2时小
c.温度为T1时,从反应开始到平衡,H2平均速率为![]()
d.平衡处于A点时密闭容器温度从T1变到T2,![]() 增大
增大
 ②300℃时,若充人1 mol CO2和
②300℃时,若充人1 mol CO2和
3 mol H2,从反应开始到平衡,测得CO2的转化率为75%。则平衡常数K为
(用最简分数表示)。
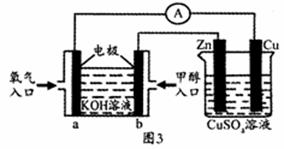
(5)将制备的甲醇(CH3OH)用于图3装置,其中b电极上发生反应的电极反应式为 ;
当铜片质量变化19.2 g时,a极上消耗的O2在标准状况下的体积为__ _L。
科目:高中化学 来源: 题型:
| 光合作用 |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| Zn的质量/g | Zn的形状 | 温度/℃ | 溶于酸的时间/s |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 45 | 25 |
E | 2 | 薄片 | 45 | 25 |
F | 2 | 粉末 | 15 | 5 |
利用上述数据,完成下列问题:
(1)画出时间对温度的曲线图。
(2)利用所画的曲线图和上述实验数据,能得出关于温度影响反应速率的什么结论?
(3)对比数据B与F,解释F溶于酸那么快的原因。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省江门市高三调研测试理综化学试卷(解析版) 题型:填空题
科学家利用淡水与海水之间含盐量的差别发明了一种新型电池——水电池。
(1)用二氧化锰纳米棒作电池正极可提高发电效率,这是利用纳米材料的 特性,使之能与钠离子充分接触。
(2)水电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,该电池的负极反应式为 。水电池工作时,Na+不断向 极方向移动。
(3)水电池生成1 mol Na2Mn5O10转移电子的物质的量为 。
(4)某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,溶液中金属阳离子的浓度与溶液pH的关系如右图。请据右图分析:

①该温度下,溶度积常数的关系为:KSP[Fe(OH)3] KSP[Mg(OH)2](填“>”、“=”或“<”);
②如果在新生成的Mg(OH)2浊液中滴入足量的FeCl3溶液,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com