
| A. | 反应中KMnO4被氧化 | |
| B. | 氧化产物与还原产物的物质的量之比为5﹕2 | |
| C. | 每生成0.5 mol Cl2时,反应中转移的电子为2 mol | |
| D. | 氧化剂和还原剂的比是1:8 |
分析 2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O中,Mn元素的化合价降低,Cl元素的化合价升高,以此来解答.
解答 解:A.Mn元素的化合价降低,则反应中KMnO4被还原,故A错误;
B.氧化产物为Cl2,还原产物为MnCl2,由反应可知氧化产物与还原产物的物质的量之比为5﹕2,故B正确;
C.每生成0.5 mol Cl2时,反应中转移的电子为0.5mol×2×[0-(-1)]=1 mol,故C错误;
D.2molKMnO4作氧化剂得到电子与10molHCl作还原剂失去电子相同,则氧化剂和还原剂的比是1:5,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握氧化还原反应中元素的化合价变化及氧化还原反应基本概念为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2中阴、阳离子的个数比为1:1 | |
| B. | Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等 | |
| C. | Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等 | |
| D. | Na2O2的漂白原理与SO2的漂白原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{2}$v(CO)=v(NO2) | B. | $\frac{1}{2}$v(NO2)=v(CO2) | C. | $\frac{1}{4}$v(N2)=v(CO2) | D. | $\frac{1}{4}$v(N2)=v(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用碘单质在酒精中的溶解度大,用酒精把碘水中的碘单质萃取出来 | |
| B. | 要分离汽油和水,最好使用蒸馏法 | |
| C. | 从含有少量氯化钠的硝酸钾溶液中提取硝酸钾,可以利用溶解度随温度变化的差异采取结晶法 | |
| D. | 要从在实验室加热氯酸钾和二氧化锰的混合物中分离得到二氧化锰,应使用分液漏斗进行分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性(吸水溶液):HSCN>H2CO3>HCN | B. | 还原性(碱性溶液):Fe(OH)2>I->KIO3 | ||
| C. | 热稳定性:NaCl>NaClO4>NaClO | D. | 氧化性(酸性溶液):I2>FeCl3>Co(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
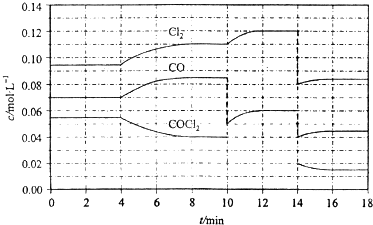
| A. | < | B. | = | ||
| C. | > | D. | 条件不足,无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.1 mol Cl2 溶于水,转移的电子数目为0.2NA | |
| B. | 标准状况下,33.6L SO3中含有硫原子的数目为1.5NA | |
| C. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目小于0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
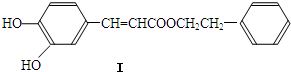
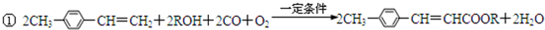
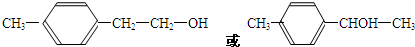 (写1种);由IV生成II的反应条件为NaOH醇溶液,加热.
(写1种);由IV生成II的反应条件为NaOH醇溶液,加热.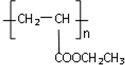 可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3.利用类似反应①的方法,仅以乙烯为有机物原料合成该单体,涉及的反应方程式为(提示:共有两步反应方程式)CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{催化剂}{→}$2CH2=CHCOOCH2CH3+2H2O.
可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3.利用类似反应①的方法,仅以乙烯为有机物原料合成该单体,涉及的反应方程式为(提示:共有两步反应方程式)CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{催化剂}{→}$2CH2=CHCOOCH2CH3+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com