
【题目】如图所示是探究某气体化学性质的实验装置,图中B为活塞。如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C中红色布条颜色褪去。则D瓶中盛有的溶液是( )
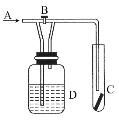
A.浓H2SO4B.饱和NaCl溶液
C.NaOH溶液D.NaBr溶液
科目:高中化学 来源: 题型:
【题目】已知:H3AO3与足量NaOH溶液反应生成NaH2AO3,25℃时,K(H3AO3)=9.7×10-11。常温下,用0.100mol/L盐酸滴定20.00mL0.100mol/L NaH2AO3溶液。溶液中c(![]() )与-lgc(OH-)的变化关系如图所示。下列说法中正确的是( )
)与-lgc(OH-)的变化关系如图所示。下列说法中正确的是( )
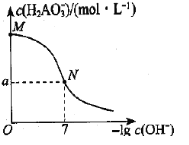
A.H3AO3为三元酸
B.溶液中水电离程度为:M<N
C.a>0.05
D.M到N过程中,溶液中存在c(Na+)=c(![]() )+c(H3AO3)
)+c(H3AO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中含有的哑铃形C2-的存在,使晶胞沿一个方向拉长(该晶胞为长方体)。下列关于CaC2晶体的说法中正确的是( )
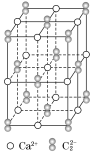
A.1个Ca2+周围距离最近且等距离的![]() 数目为6
数目为6
B.6.4 g CaC2晶体中含阴离子0.1 mol
C.该晶体中只有离子键
D.与每个Ca2+距离相等且最近的Ca2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次 增大。在如图所示的物质转化关系中,p、q、 m.n分别是元素W、X、Y、Z的气体单质,p和 s均为有色气体,v的水溶液呈碱性。常温下,0.1 mol L -1 ,t 溶液与 0.1 mol L -1 u 溶液的pH均为1。下列说法不正确的是
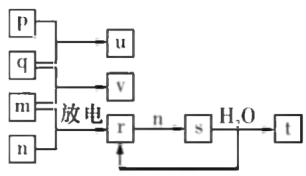
A.Y、W的兹高价氧化物对应的水化物均为强酸
B.元索的非金属性:Z>Y>X;原子半径:X<Z<Y
C.s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2
D.的电子式可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
废旧可充电电池主要含有Fe、Ni、Cd、Co等金属元素,一种混合处理各种电池回收金属的新工艺如下图所示。
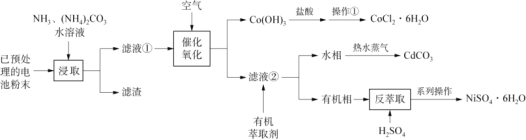
已知:Ⅰ.滤液①中含有Ni(NH3)62+、Cd(NH3)42+、Co(NH3) 62+等物质。
Ⅱ.萃取和反萃取的反应原理分别为:
Ni(NH3)62++ 2HR![]() NiR2+2NH4++4NH3 ;NiR2+2H+
NiR2+2NH4++4NH3 ;NiR2+2H+![]() Ni2+ +2HR
Ni2+ +2HR
(1)为了加快浸取速率,可采取的措施为__________(任写一条)。
(2)已知浸取过程中NH3和NH4+的物质的量之和与Ni、Cd、Co浸取率的关系如表2所示。
表2 浸取过程中氨总量与各离子浸取率的关系
编号 | n(NH3)+ n(NH4+)/mol | Ni浸取率/% | Cd浸取率/% | Co浸取率/% |
① | 2.6 | 97.2 | 88.6 | 98.1 |
② | 3.5 | 86.0 | 98.8 | 86.7 |
③ | 4.8 | 98.4 | 98.8 | 94.9 |
④ | 5.6 | 97.7 | 85.1 | 96.8 |
⑤ | 9.8 | 95.6 | 84.1 | 96.1 |
则可采用的最佳实验条件编号为_____。
(3)Co(OH)3与盐酸反应产生气体单质,该反应的化学方程式______。
(4)操作①的名称为_________、过滤、洗涤。
(5)向有机相中加入H2SO4能进行反萃取的原因为_______(结合平衡移动原理解释)。
(6)将水相加热并通入热水蒸气会生成CdCO3沉淀,并产生使红色石蕊试纸变蓝的气体,该反应的离子方程式为___。
(7)上述工艺流程中可能循环使用的物质为______。
(8)已知Ksp(CdCO3)=1.0×10-12,Ksp(NiCO3)=1.4×10-7。若向物质的量浓度均为0.2mol/L的Cd2+和Ni2+溶液中滴加Na2CO3溶液(设溶液体积增加1倍),使Cd2+恰好沉淀完全,即溶液中c(Cd2+)=1.0×10-5mol/L时,是否有NiCO3沉淀生成(填“是”或者“否”)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝) +3KCl,回答问题:
(1)写出基态Fe3+的核外电子排布式_________。
(2)K4[Fe(CN)6]中的作用力除共价键外,还有______和________。含有12mol σ键的K4[Fe(CN)6的物质的量为________mol。
(3)黄血盐中N原子的杂化方式为______;C、N、O的第一电离能由大到小的排序为_____,电负性由大到小的排序为________。
(4)Fe、Na、K的晶体结构如图所示:
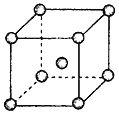
① 钠的熔点比钾更高,原因是__________________________。
② Fe原子半径是r cm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_______g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 NA是阿伏加德罗常数的值,下列说法正确的是
A.32gS8与 S6(![]() )的混合物中所含共价键数目为NA
)的混合物中所含共价键数目为NA
B.1L0.1mol L-1H2C2O4溶液中含 C2O42- 离子数为0.1NA
C.2molNO与 2molO2在密闭容器中充分反应,转移的电子数为 8NA
D.标准状况下 22.4L氯气与甲烷的混合气体,光照时充分反应生成 HCl分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略)。首先在U形管内加入少量煤油和几粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,一段时间后加热铜丝。
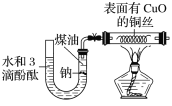
根据反应中观察到的现象,回答下列问题:
(1)金属钠的变化现象________。
(2)U形管中溶液的颜色_____,说明有__________生成。
(3)铜丝的变化现象____________,说明有________生成;若去掉后面的装置,简述检验气体的方法____
(4)若a g钠与b mL水完全反应,则该溶液溶质的质量分数是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是
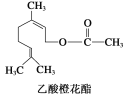
①属于芳香族化合物;②不能发生银镜反应;③分子式为C12H20O2;④它的同分异构体中可能有酚类;⑤1mol该有机物水解时只能消耗1molNaOH
A.②③④B.①④⑤C.①②③D.②③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com