
【题目】室温下,用0.1mol·L-1的NaOH溶液分别滴定相同浓度的弱酸HX、HY的稀溶液,其滴定曲线如图所示。下列说法错误的是( )
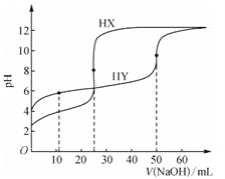
A.HX的酸性比HY的强B.滴定过程中,均可用酚酞作指示剂
C.室温下,Ka(HY)的数量级约为10-4 D.滴定前,HY的体积为HX的两倍
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.0.2mol丁烷完全裂解生成乙烯的分子数一定为0.2NA
B.13gNaN3爆炸分解为Na和N2 , 转移电子数为0.2NA
C.1L0.1mol·L-1(NH4)2SO3溶液中,含NH4+数目为0.2NA
D.0.2molN2O4充入密闭容器中,产生气体分子总数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将a g二氧化锰粉末加入b mol/L的浓盐酸c L中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是
A.可以收集到氯气![]() L
L
B.NA可表示为:![]()
C.反应后溶液中的Cl―数目为:![]()
D.反应后溶液中的H+数目为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热化学:(1)已知:C(s)+H2O(l)=CO(g)+H2(g) ΔH1=a kJ·mol-1;
2CO(g)+O2(g)=2CO2(g) ΔH2=bkJ·moL-1;
2H2(g)+O2(g)=2H2O(l) ΔH3=ckJ·moL-1;
则C(s)+O2(g)=CO2(g) ΔH=___(用a、b、c表示)kJ·moL-1。
(2)根据键能数据估算CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热ΔH=___。
化学键 | C—H | C—F | H—F | F—F |
键能(kJ·mol-1) | 414 | 489 | 565 | 155 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的每一方格表示有关的一种反应物或生成物,其中甲、乙、丙、丁为常见单质,其余均为化合物。A是一种常见的液态化合物,B是具有磁性的氧化物,D和丁既能和酸反应又能和碱反应,乙在丙中燃烧产生苍白色火焰,H在空气中很容易被氧化为I2。它们的转化关系如下:(有些反应的条件和部分产物为注明)
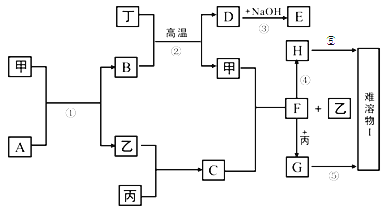
(1)写出下列物质化学式:B_________,F_______________;
(2)写出反应①的化学方程式:____________________;
(3)H在空气中很容易被氧化为I,该过程的实验现象是__________________;
(4)将足量的CO2通入E溶液中,离子方程式是___________________。
(5)将G的饱和溶液滴入沸水中得红褐色液体,该液体具有的性质有__________。
A.具有丁达尔现象 |
B.红褐色液体可用过滤的方法纯化 |
C.液体中分散质微粒直径小于1nm |
D.取适量液体加入K2SO4溶液会产生红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R元素的一种原子可表示为:![]() ,则下列说法中正确的是
,则下列说法中正确的是
A.R元素的相对原子质量的近似整数值在数值上等于A
B.R元素的近似相对原子质量为A
C.R元素的近似相对原子质量为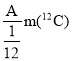 (其中m(
(其中m(![]() )表示一个碳-12原子的质量)
)表示一个碳-12原子的质量)
D.无法计算出R元素的近似相对原子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,把0.1molN2O4气体通入体积为lL的恒容密闭容器中,立即出现红棕色。在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A.压缩容器,颜色变浅
B.在平衡时体系内含N2O40.04mol
C.以N2O4的浓度变化表示的平均反应速率为0.002mol/(L·s)
D.平衡时,如果再充入一定量N2O4,则可提高N2O4的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中正确的是![]()
A.稀硝酸与过量的铁屑反应:![]()
B.硫酸铝溶液与过量的氨水反应:![]()
C.苯酚钠的水溶液中通入少量的![]() :
:![]()
D.醋酸钠的水解反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.1 mol O2的体积是22.4 L
B.1.7 g NH3中含有的质子数约为6.02×1023
C.8 g S在足量O2中完全燃烧转移的电子数约为3.01×1023
D.0.5 mol·L1NaCl溶液中含有Cl的物质的量为0.5 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com