
| A.Mg2+ + 2HCO3- + 2Ca2+ + 4OH-= Mg(OH)2↓+ 2CaCO3↓+ 2H2O |
| B.Cu2+ + H2S = CuS↓+ 2H+ |
| C.Zn2+ + S2- + 2H2O = Zn(OH)2↓+ H2S↑ |
| D.FeS + 2H+= Fe2+ + H2S↑ |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
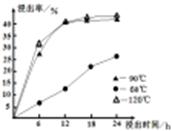
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:问答题
| 农作物 | 水稻 | 马铃薯 | 烟草 | 薄荷 | 棉花 | 小麦 |
| pH值 | 6-7 | 4.8-5.5 | 5-6 | 7-8 | 6-8 | 6.3-7.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③④ | B.②③④ | C.①②③ | D.①③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2. 3×10-7mol·L-1 | B.4. 6×10-7mol·L-1 |
| C.9. 2×10-7mol·L-1 | D.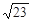 ×10-3mol·L-1 ×10-3mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
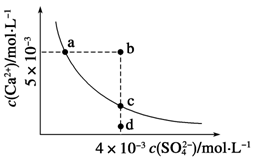
| A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液 |
| B.a点对应的Ksp不等于c点对应的Ksp |
C.b点将有沉淀生成,平衡后溶液中c(SO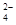 )一定等于3×10-3 mol·L-1 )一定等于3×10-3 mol·L-1 |
| D.向d点溶液中加入适量CaCl2固体可以变到c点 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
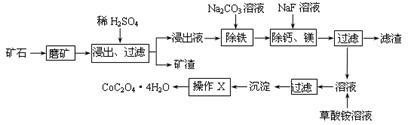
 CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
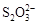

 +2I―。相关物质的溶度积常数见下表:
+2I―。相关物质的溶度积常数见下表:| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
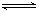 Ca(OH)2(aq)
Ca(OH)2(aq)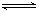 Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是( )
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是( )| A.n(Ca2+)增大 | B.c(Ca2+)不变 | C.n(OH-)增大 | D.c(OH-)减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com