
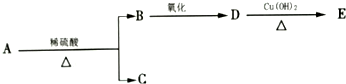
 分子式为C9H18O2的有机物A有下列转化关系:其中B、C的相对分子质量相等,则A的可能的结构简式有( )
分子式为C9H18O2的有机物A有下列转化关系:其中B、C的相对分子质量相等,则A的可能的结构简式有( )| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
分析 有机物A的分子式为C9H18O2,在酸性条件下水解为B和C两种有机物,则有机物A为酯,由于B与C相对分子质量相同,因此酸比醇少一个C原子,说明水解后得到的羧酸含有4个C原子,而得到的醇含有5个C原子,判断5个碳原子醇属于醇的同分异构体,其中能被氧化成羧酸,说明羟基所连碳上有2个氢原子,4个碳原子羧酸属于羧酸的异构体数目,据此判断有机物A的同分异构体数目.
解答 解:有机物A的分子式为C9H18O2,在酸性条件下水解为B和C两种有机物,则有机物A为酯,由于B与C相对分子质量相同,因此酸比醇少一个C原子,说明水解后得到的羧酸含有4个C原子,而得到的醇含有5个C原子,含有4个C原子的羧酸有2种同分异构体:CH3CH2CH2COOH,CH3CH(CH3)COOH;
含有5个C原子的醇的有8种同分异构体:CH3CH2CH2CH2CH2OH,CH3CH2CH2CH(OH)CH3,CH3CH2CH(OH)CH2CH3;CH3CH2CH(CH3)CH2OH,CH3CH2C(OH)(CH3)CH3,CH3CH(OH)CH(CH3)CH3,CH2(OH)CH2CH(CH3)CH3;CH3C(CH3)2CH2OH,其中醇能能被氧化成羧酸,说明羟基所连碳上有2个氢原子,共有4种,所以有机物甲的同分异构体数目有2×4=8;
故选B.
点评 本题考查同分异构体数目的判断,难度不大,清楚饱和一元醇与少一个C原子的饱和一元羧酸的相对分子质量相同以及醇氧化的条件是解题关键,同时掌握组合法的使用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A>B>C>D | B. | 原子序数:d>c>b>a | ||
| C. | 离子半径:C2->D->B+>A2+ | D. | 单质的还原性:A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 同温同压下,相同体积的氟气和氩气所含的原子数相等 | |
| B. | 标准状况下,1.12 L NO与1.12 L O2的混合物中含有的原子数为0.2NA | |
| C. | 常温下,1L 0.1 mol•L-1 CuSO4溶液中含有的Cu2+数目为0.1NA | |
| D. | 25℃时,1L pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.
;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.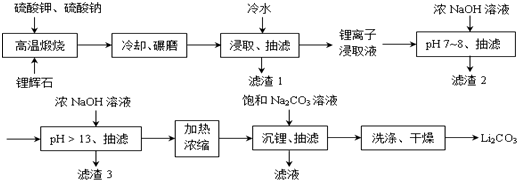
| 金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
| 温度 溶解度 | 10℃ | 20℃ | 50℃ | 80℃ |
| Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
| Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CCl4提取碘水中的碘 | |
| B. | 用NaOH溶液除去溴苯中的溴 | |
| C. | 用酒精除去苯酚中的甘油 | |
| D. | 用饱和Na2CO3溶液除去乙酸丁酯中的乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤液化制得清洁能源 | B. | 用酒精测试仪检测酒驾 | ||
| C. | 将氯气通入冷的消石灰中制漂白粉 | D. | 从海水中提取氯化镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
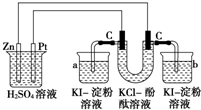 按照如图接通线路,反应一段时间后,回答下列问题(假设所提供的电能可以保证电解反应的顺利进行):
按照如图接通线路,反应一段时间后,回答下列问题(假设所提供的电能可以保证电解反应的顺利进行):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com