
【题目】(1)已知2P4+9KOH+3H2O═3K3PO4+5PH3反应中氧化剂是______; 氧化剂与还原剂物质的量之比是_________;氧化产物是____________。
(2)请用双线桥法标出下列反应电子转移的方向和数目10Al+6NaNO3 +4NaOH═10NaAlO2 +3N2↑+2H2O______________________
(3)Mn2+、Bi3+、BiO3﹣、MnO4﹣、H+、H2O组成的一个氧化还原系统中,发生BiO3﹣→Bi3+的反应过程,据此回答下列问题 ①该氧化还原反应中,被还原的元素是____________。
②请将氧化剂、还原剂的化学式及配平后的方程式填入下列相应的位置中,并用单线桥法标出电子转移的方向和数目_______________________________________。
【答案】P4 5:3 K3PO4 ![]() Bi
Bi ![]()
【解析】
(1)在2P4+9KOH+3H2O═3K3PO4+5PH3反应中P元素的化合价既升高,又降低;
(2)该反应中Al元素化合价由0价变为+3价、N元素化合价由+5价变为0价,该反应中转移电子数为30,电子由Al转给硝酸钠;
(3)①该反应中Bi元素化合价由+5价变为+3价,则Mn元素化合价由+2价变为+7价,失电子的元素被氧化、得电子的元素被还原;
②该反应中Bi元素化合价由+5价变为+3价,则Mn元素化合价由+2价变为+7价,转移电子数为10,电子由Mn2+转给BiO3-。
(1)在2P4+9KOH+3H2O═3K3PO4+5PH3反应中P元素的化合价从0价升高为+5价,同时从0价降为-3价,则P4既是氧化剂,又是还原剂;且氧化剂与还原剂物质的量之比是5:3,氧化产物是K3PO4;
(2)该反应中Al元素化合价由0价变为+3价、N元素化合价由+5价变为0价,该反应中转移电子数为30,电子由Al转给硝酸钠,其转移电子方向和数目![]() ;
;
(3)①该反应中Bi元素化合价由+5价变为+3价,则Mn元素化合价由+2价变为+7价,失电子的元素被氧化、得电子的元素被还原,所以被还原的元素是Bi元素;
②BiO3-为氧化剂,Mn2+为还原剂,反应2Mn2++5BiO3-+14H+═2MnO4-+5Bi3++7H2O中,Mn失去2×5e-,反应中转移10e-,所以单线桥法标电子转移的方向和数目为![]() 。
。
故答案为:Mn2+;BiO3-;2MnO4-+5Bi3++7H2O。


科目:高中化学 来源: 题型:
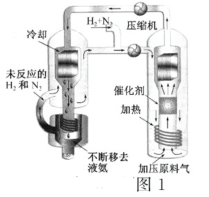
【题目】(一)合成氨工艺(流程如图1所示)是人工固氮最重要的途径。2018年是合成氨工业先驱哈伯(F·Haber)获得诺贝尔奖100周年。
N2和H2生成NH3的反应为:![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g)△H(298K)=-46.2kJ·mol-1
NH3(g)△H(298K)=-46.2kJ·mol-1
在Fe催化剂作用下的反应历程为(*表示吸附态)
化学吸附:N2(g)→2N*;H2(g)![]() 2H*
2H*
表面吸附:N*+H*![]() NH*;NH*+H*
NH*;NH*+H*![]() NH2*;NH2*+H*
NH2*;NH2*+H*![]() NH3*
NH3*
脱附:NH3*![]() NH3(g)
NH3(g)
其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
请回答:
(1)利于提高合成氨平衡产率的条件有_______________
A.低温B.高温C.低压D.高压E.催化剂
(2)标准平衡常数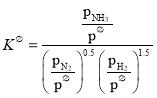 ,其中
,其中![]() 为标准压强1×105Pa,
为标准压强1×105Pa,![]() 、
、![]() 和
和![]() 为各组分的平衡分压,如
为各组分的平衡分压,如![]() =
=![]() p,p为平衡总压,
p,p为平衡总压,![]() 为平衡系统中NH3的物质的量分数
为平衡系统中NH3的物质的量分数
①N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,NH3的平衡产率为ω,则![]() =____________(用含ω的最简式表示)
=____________(用含ω的最简式表示)
②图中可以示意标准平衡常数K随温度T变化趋势的是____________
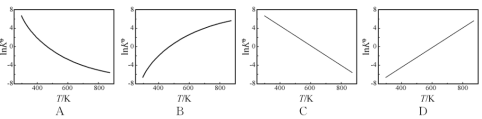
(3)实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8
①分析说明原料气中N2过量的理由____________
②关于合成氨工艺的下列理解,正确的是____________
A.合成氨反应在不同温度下的△H和△S都小子零
B.控制温度(773K)远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
E.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
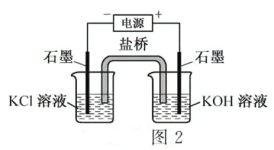
(二)高铁酸钾(K2FeO4)可用作水处理剂口某同学通过“化学一电解法”探究K2FeO4的合成,其原理如图2所示.接通电源,调节电压,将一定量C12通入KOH溶液,然后滴入含Fe3+的溶液,控制温度,可制得K2FeO4
(1)请写出“化学法”得到FeO42一的离子方程式____________
(2)请写出阳极的电极反应式(含FeO42-)____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Persi等人以LiTi2O4作负极,LiFePO4作正极,采用LiClO4-EC-PC-PVdF凝胶作电解质溶液,组成新型锂离子二次电池,电池隔板只允许Li+通过,该锂离子二次电池的结构示意图如图,下列说法不正确的是
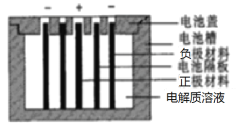
A.若正、负极材料质量相等,当外电路转移1 mol e-时,两极质量差为14g
B.放电时,LiFePO4电极的电势低于LiTi2O4的电势
C.放电时,电解质溶液中的Li+向LiFePO4一极移动
D.充电时,LiFePO4电极接电源的正极,发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CS2是一种常见溶剂,还可用于生产人造粘胶纤维等。回答下列问题:
(1)CS2与酸性KMnO4溶液反应,产物为CO2和硫酸盐,该反应中还原剂与氧化剂的物质的量之比为__________(MnO4-被还原为Mn2+)。
(2)甲烷硫磺法制取CS:的反应为CH4(g)+2S2(g)![]() CS2(g)+2H2S(g) △H
CS2(g)+2H2S(g) △H
①在恒温恒容密闭容器中进行该反应时,能说明该反应已达到平衡状态的是_________(填字母)。
A.v正(S2)=2v逆(CS2)
B.容器内气体的密度不再随时间变化
C.容器内气体的总压强不再随时间变化
D.单位时间内断裂C-H键数目与断裂H-S键数目相等
②已知下列键能数据:
共价键 | C-H | S=S | C=S | H-S |
键能/ | 411 | 425 | 573 | 363 |
该反应的△H=_________kJ·mol-1。
(3)在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S):n(CH4)=2:1,发生反应:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。0.1MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
CS2(g)+4H2(g)。0.1MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
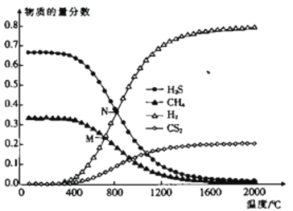
①该反应△H_________(填“>”或“<”)0。
②M点对应温度下,H2S的平衡转化率为_________,为提高H2S的平衡转化率,除改变温度外,还可采取的措施是___________________________(列举一条)。
③N点,平衡分压p(CS2)=_________MPa,对应温度下,该反应的Kp=_________(MPa)2。(Kp为以分压表示的平衡常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为5L的密闭容器中,0.5molX和0.5molY进行反应:
2X(g)+Y(g)![]() 2Z(g),经60s达到平衡,生成0.2molZ。下列说法正确的是:
2Z(g),经60s达到平衡,生成0.2molZ。下列说法正确的是:
A. 将容器体积变为10L,Z的平衡浓度变为原来的![]()
B. 在该温度下,该反应的平衡常数K=0.011
C. 达到平衡时,容器内气体的压强是原来的90%
D. 若降低温度,X的体积分数增大,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积固定的密闭容器中发生反应:C(s)+H2O(g) ![]() CO(g)+H2(g),下列说法中,不能说明反应达到化学平衡状态的是
CO(g)+H2(g),下列说法中,不能说明反应达到化学平衡状态的是
A. 容器内CO的物质的量分数保持不变B. 容器内体系的压强保持不变
C. 容器内气体的密度保持不变D. 单位时间内消耗1molH2O(g),同时生成1molCO(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)===PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s的平均速率v(PCl3)=0.0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D. 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种常用的镇静、麻醉药物I,其合成路线如下。
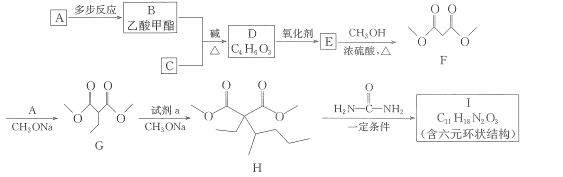
已知:①B、C互为同分异构体
②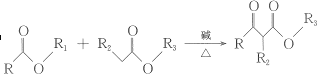 +R1OH;
+R1OH;
③ +R3Br+CH3ONa
+R3Br+CH3ONa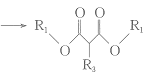 +CH3OH+NaBr;
+CH3OH+NaBr;
④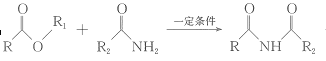 + R1OH;
+ R1OH;
其中 R、R2代表烃基或氢原子,R1、R3代表烃基。回答下列问题。
(1)试剂a为溴代物,其名称为_____,G中官能团的名称为____,G-H的反应类型为____。
(2)I的结构简式为__。
(3)写出 B+C→D的化学方程式:__________________
(4)设计实验区分B、D,所选用的试剂为___________________。
(5)已知羟基与碳碳双键直接相连的结构不稳定,同一个碳原子上连接多个羟基的结构不稳定,满足下列要求的D的所有同分异构体共有______种,写出其中互为顺反异构物质的结构简式:___________。
a.能发生银镜反应;b.能发生水解反应;c.能使Br2的CCl4溶液褪色;d.能与Na反应。
(6)参照上述合成路线,请写出以 CH2BrCH2CH2Br、CH3OH、CH3ONa 为原料(无机试剂任选),制备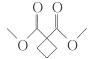 的合成路线:____________________________。
的合成路线:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示,下列说法错误的是
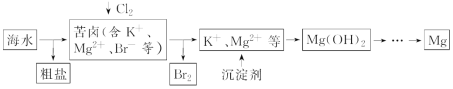
A.粗盐可采用除杂和重结晶等过程提纯
B.向苦卤中通入Cl2是为了提取溴
C.实际生产中常选用Ca(OH)2作为沉淀剂
D.工业生产中电解氯化镁溶液的方法制取镁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com