
| �ܶ� | �е� | �ܽ��� | ||
| ��ϩ�� | 1.05g/cm3 | 141�� | ��ˮ���ܣ��������л��ܼ� | �ж� |
| �״� | 0.79g/cm3 | 64.7�� | ��ˮ���ܣ��������л��ܼ� | �ӷ����ж� |
| ��ϩ����� | 0.95g/cm3 | 80.5�� | ������ˮ���������л��ܼ� | �ӷ� |
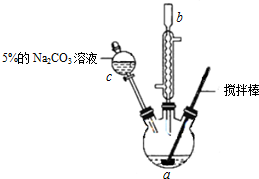
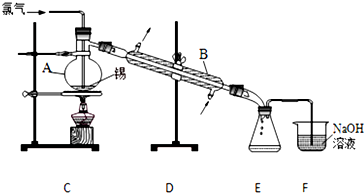
���� ��1������װ��ͼ��֪����c�����ƣ�
��2�����Һ���б�ϩ���������ϩ�ᡢ�״�����ϩ������Na2CO3��Һ��Ӧ���״�������̼������Һ�У�
��3����ϩ��ͼ״�������ȼ������Ҫ��ֹ���𣬼״��ӷ�������Ҫ��ͨ�����ʵ�飻
��4���������з����Ļ�ѧ��ӦΪCH2=CHCOOCH3��KOH ��Ӧ��
��5���к�����KOH���ε��յ�ʱ����������20.00mL����0.5��0.02mol=0.01mol����������ˮ���KOH�����ʵ���Ϊ0.025mol-0.01mol=0.015mol��������������CH2=CHCOOCH3��CH2=CHCOOH������Ϊ0.015mol��72g/mol=1.08g���μ�ʵ�����ƷΪԭ��Ʒ��$\frac{1}{5}$���ݴ˿ɼ����ϩ���ת���ʣ�
��� �⣺��1������װ��ͼ��֪����c������Ϊ��Һ©����
�ʴ�Ϊ����Һ©����
��2�����Һ���б�ϩ���������ϩ�ᡢ�״�����ϩ������Na2CO3��Һ��Ӧ���״�������̼������Һ�У�������5%0Na2CO3��Һϴ�ӵ�Ŀ���dz�ȥ���Һ�еı�ϩ��ͼ״������ͱ�ϩ��������ܽ�ȣ���
�ʴ�Ϊ����ȥ��ϩ�ᡢŨ������������ʣ�
��3����ϩ��ͼ״�������ȼ������Ҫ��ֹ���𣬼״��ӷ�������Ҫ��ͨ�����ʵ�飬���Ա�ʵ������Ҫ��ȡ�İ�ȫ������ʩΪͨ�����ʵ�顢��ֹ����
�ʴ�Ϊ��ͨ�����ʵ�飻
��4���������з����Ļ�ѧ��Ӧ����ʽΪ��CH2=CHCOOCH3+KOH $\stackrel{��}{��}$CH2=CHCOOK+CH3OH��
�ʴ�Ϊ��CH2=CHCOOCH3+KOH $\stackrel{��}{��}$CH2=CHCOOK+CH3OH��
��5���к�����KOH���ε��յ�ʱ����������20.00mL����0.5��0.02mol=0.01mol����������ˮ���KOH�����ʵ���Ϊ0.025mol-0.01mol=0.015mol��������������CH2=CHCOOCH3��CH2=CHCOOH������Ϊ0.015mol��72g/mol=1.08g���μ�ʵ�����ƷΪԭ��Ʒ��$\frac{1}{5}$�����Ա�ϩ���ת����Ϊ$\frac{1.08}{10��\frac{1}{5}}$��100%=54.0%��
�𣺲���Ϊ54.0%��
���� ���⿼���л���ĺϳɣ����ضԻ�ѧʵ��Ŀ��飬�漰��װ�õ����⡢���ʵķ����ᴿ����ʵ�������Ŀ��ơ������ݵķ��������ȣ��Ѷ��еȣ���Ҫѧ������֪ʶ�Ļ������������������


 �Ͻ�ƽСѧ��������ϵ�д�
�Ͻ�ƽСѧ��������ϵ�д� �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
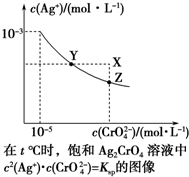 ��֪t��ʱAgCl��Ksp=4��10-10����t��ʱ��Ag2CrO4��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵��������ǣ�������
��֪t��ʱAgCl��Ksp=4��10-10����t��ʱ��Ag2CrO4��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵��������ǣ�������| A�� | ��t��ʱ��Ag2CrO4��KspΪ1��10-11 | |
| B�� | �ڱ�����Һ�м���K2CrO4��s����ʹ��Һ��Y�㵽Z�� | |
| C�� | ��t�棬Ag2CrO4��s��+2Cl-��aq��?2AgCl��s��+CrO${\;}_{4}^{2-}$��aq��ƽ�ⳣ��K=6.25��107 | |
| D�� | ��t��ʱ����0.001 mol•L-1 AgNO3��Һ�ζ�20 mL 0.001 mol•L-1 KCl��0.001 mol•L-1��K2CrO4�Ļ����Һ��CrO${\;}_{4}^{2-}$�ȳ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 1-����鳣�����л���Ӧ���ܼ���ʵ�����Ʊ�1-����飨CH3CH2CH2Br���ķ�Ӧ����Ҫʵ��װ�����£�
1-����鳣�����л���Ӧ���ܼ���ʵ�����Ʊ�1-����飨CH3CH2CH2Br���ķ�Ӧ����Ҫʵ��װ�����£�| ��Է� ������ | �ܶ� /g•mL-1 | �е�/�� | ˮ�� �ܽ��� | |
| ������ | 60 | 0.896 | 97.1 | �� |
| ������ | 102 | 0.74 | 90 | �������� |
| 1-����� | 123 | 1.36 | 71 | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
��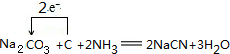 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
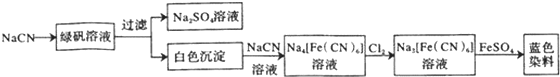
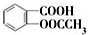 ����������Ӧ����㷺�Ľ��ȡ���ʹ�Ϳ���ҩ������ˮ���������ֽ⣬�ֽ��¶�Ϊ128�桫135�森ijѧϰС����ʵ������ˮ���ᣨ���ǻ������ᣩ�������Ϊ��Ҫԭ�Ϻϳɰ�˾ƥ�֣���Ӧԭ�����£�
����������Ӧ����㷺�Ľ��ȡ���ʹ�Ϳ���ҩ������ˮ���������ֽ⣬�ֽ��¶�Ϊ128�桫135�森ijѧϰС����ʵ������ˮ���ᣨ���ǻ������ᣩ�������Ϊ��Ҫԭ�Ϻϳɰ�˾ƥ�֣���Ӧԭ�����£�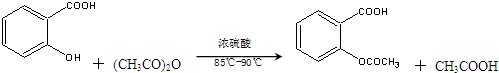
| ���� | ��Է������� | �۵��е㣨�棩 | ˮ���� |
| ˮ���� | 138 | 158���۵㣩 | �� |
| ������ | 102 | 139.4���е㣩 | ��ˮ�� |
| ����ˮ���� | 180 | 135���۵㣩 | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
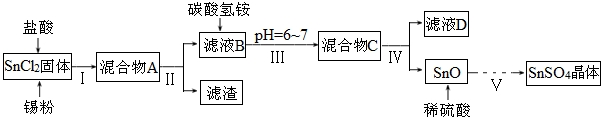
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
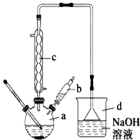 �屽��һ�ֳ��õĻ���ԭ�ϣ�ʵ�����Ʊ��屽��ʵ�鲽�����£�
�屽��һ�ֳ��õĻ���ԭ�ϣ�ʵ�����Ʊ��屽��ʵ�鲽�����£�| �� | �� | �屽 | |
| �ܶ�/gcm-3 | 0.88 | 3.10 | 1.50 |
| �е�/�� | 80 | 59 | 156 |
| ��ˮ�е��ܽ�� | �� | �� | �� |
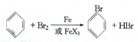 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ij��ѧѧϰС����о������ǣ�̽���ⶨ���ᾧ�壨H2C2O4•xH2O����x��ֵ������ͬѧͨ���������ϲ�Ѱ�ã�����������ˮ��ˮ��Һ����������KMnO4��Һ���еζ���
ij��ѧѧϰС����о������ǣ�̽���ⶨ���ᾧ�壨H2C2O4•xH2O����x��ֵ������ͬѧͨ���������ϲ�Ѱ�ã�����������ˮ��ˮ��Һ����������KMnO4��Һ���еζ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
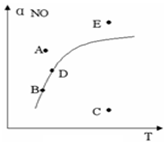 ����������һ��ʱ��ͼ�����߱�ʾ��Ӧ2NO��g��+O2��g��?2NO2��g����H��0��ƽ��ʱNO ��ת�������¶ȵĹ�ϵ��ͼ�ϱ���A��B��C��D��E�㣬�����й�˵����ȷ���ǣ�������
����������һ��ʱ��ͼ�����߱�ʾ��Ӧ2NO��g��+O2��g��?2NO2��g����H��0��ƽ��ʱNO ��ת�������¶ȵĹ�ϵ��ͼ�ϱ���A��B��C��D��E�㣬�����й�˵����ȷ���ǣ�������| A�� | A�㷴Ӧδ�ﵽƽ��״̬���ҷ�Ӧ�����ƶ� | |
| B�� | C��NOת������ͣ��һ�ѧ��Ӧ������С | |
| C�� | B��D�����������Ӧ�¶��µĻ�ѧƽ��״̬���Ҧ�B��NO������D��NO�� | |
| D�� | E�㷴Ӧδ��ƽ�⣬��Ӧ�����ƶ���������ѹǿ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com