
| 族 周期 |
||||||||
| ① | ||||||||
| ② | ||||||||
| ③ | ④ | ⑤ | ⑥ | |||||
 ,
, 等;
等; 2SO3,
2SO3, 2SO3.
2SO3.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
| A、2.24 L H2O中含有的原子总数为0.3NA |
| B、O.5 mol?L一1CuCl2溶液中含有0.5 NA个Cu2+ |
| C、等质量的O2和O3所含分子数相等 |
| D、一个12C原子的质量是12/NA g |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO.据此回答下列问题:
有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO.据此回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 ③白磷 ④氯气⑤
③白磷 ④氯气⑤ ⑥
⑥37 17 |
35 17 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓H2SO4 |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
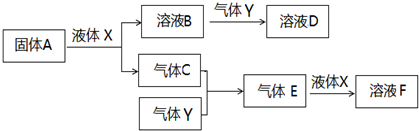
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓度均为0.1 mol/L的HF、KF混合溶液中:2c(H+)+c(HF)═2c(OH-)+c(F-) |
| B、0.1 mol/L的Na2CO3溶液中:2c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3) |
| C、常温下,pH=5的NaHSO3溶液中,水电离出的c(H+)=1.0×10-9 mol/L |
| D、铵根离子浓度均为0.1 mol/L的 ①NH4Cl、②NH4Al(SO4)2、③NH4HCO3三种溶液的浓度:③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PM2.5是指大气中直径小于或等于2.5微米(1 微米=1×10-6 米)的颗粒物,也称为“细颗粒物”,PM2.5在空气中只形成气溶胶 |
| B、核磁共振仪、红外光谱仪、紫外光谱仪、质谱仪都可用于有机化合物结构的分析 |
| C、石油裂解、煤的液化、橡胶老化、海水制镁、纯碱晶体风化、纤维素制火棉等过程中都包含化学变化 |
| D、维勒打破了无机物和有机物的界限,卢瑟福提出了带核的原子结构模型 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com