
下列关于化学平衡常数(K),电离平衡常数(Ka或Kb),水解平衡常数(Kh),沉淀溶解平衡常数(Ksp),水的离子积常数(Kw)的叙述中错误的是
| A.K值越大,正反应进行的程度越大,一般地说,K>105时,该反应进行得就基本完全了 |
| B.比较Ksp与离子积Qc的相对大小,可判断难溶电解质在给定条件下沉淀能否生成或溶解 |
| C.K、Ka或Kb、Kh、Ksp、Kw都与温度有关,温度越高,常数值越大 |
| D.弱酸HA的Ka与NaA的Kh、水的离子积常数Kw三者间的关系可表示为:Kw=Ka ·Kh |
C
解析试题分析:A、相同条件下不同反应的K值越大,表示反应进行的程度越大;相同的化学反应在不同条件下,K值越大,表示反应进行的程度越大,故A正确;B、比较Ksp与离子积Qc的相对大小,可判断难溶电解质在给定条件下沉淀能否生成或溶解,Qc>Ksp时 ,溶液过饱和有沉淀析出;Qc=Ks时,溶液饱和,沉淀与溶解处于平衡状态;Qc<Ksp时,溶液不饱和无沉淀析出,故B正确;C、平衡常数都是温度的函数,随温度变化做相应的变化,电离平衡常数、水的离子积常数和溶解平衡常数温度升高其值都增大,但是化学平衡常数随温度的变化和反应的吸放热情况有关,故C错误;水解和电离为可逆过程,Ka= ,Kb=
,Kb=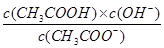 ;则有Ka?Kh=Kw,故D正确。
;则有Ka?Kh=Kw,故D正确。
考点:化学平衡常数的含义


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
CO(g)+H2O(g) CO2(g)+H2(g)+Q,将1molCO和1molH2O置于密闭容器中发生上述反应,其他条件不变的情况下,下列叙述正确的是
CO2(g)+H2(g)+Q,将1molCO和1molH2O置于密闭容器中发生上述反应,其他条件不变的情况下,下列叙述正确的是
| A.加入催化剂,改变了反应的途径,反应放出的热量也随之改变 |
| B.改变压强,平衡不发生移动,反应放出的热量不变 |
| C.升高温度,反应速率加快,反应放出的热量不变 |
| D.若将该反应设计成原电池,反应放出的热量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.氨水加水稀释后,溶液中c(NH3·H2O) /c(NH4+)的值减小 |
| B.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 |
| C.常温下,2NO(g)+O2(g)=2NO2(g)能够自发进行,则该反应的△H<0 |
| D.相同条件下,Na2CO3溶液的碱性强于C6H5ONa,说明C6H5OH的酸性强于H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
反应N2+3H2 2NH3刚开始时,N2的浓度为3 mol/L,H2的浓度为5 mol/L,3 min后测得NH3浓度为0.6 mol/L,则此时间内,下列反应速率表示正确的是
2NH3刚开始时,N2的浓度为3 mol/L,H2的浓度为5 mol/L,3 min后测得NH3浓度为0.6 mol/L,则此时间内,下列反应速率表示正确的是
| A.v(NH3)="0.2" mol/(L·s) | B.v(N2)="1.0" mol/(L·min) |
| C.v(H2)="1.67" mol/(L·min) | D.v(H2)="0.3" mol/(L·min) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下,对于可逆反应X(g)+3Y(g)  2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.12 mol/L,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.12 mol/L,则下列判断正确的是( )
| A.c1 : c2=1 : 3 |
| B.平衡时,3VY (正) =2VZ (逆) |
| C.X、Y的转化率相等 |
| D.c1的取值范围为0.06<c1<0.16 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某实验小组以H2O2分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验②的反应物应为
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | | 无 |
| ③ | 10 mL 5% H2O2溶液 | MnO2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
足量的锌与酸反应,欲使制取氢气的反应速率尽可能大,选用的反应条件正确的组合是
①锌粒 ②锌粉 ③加少量的硫酸银的饱和溶液 ④1mol/L的盐酸 ⑤5mol/L的硝酸
⑥1mol/L的硫酸 ⑦加热 ⑧加大量的硫酸铜晶体 ⑨不断振荡 ⑩加大体系的压强
| A.②③⑥⑦⑨ | B.①③⑤⑦⑩ | C.②④⑥⑦⑧⑨ | D.②⑦⑧⑨⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列事实不能用勒夏特列原理解释的是
| A.热的纯碱溶液比冷的纯碱溶液洗涤油污效果更好 |
| B.配制FeCl3溶液时,在溶液中加入少量稀盐酸 |
| C.等质量粉末状与块状碳酸钙分别与同浓度的盐酸反应,粉末状比块状的反应快 |
| D.新制的氯水在光照条件下颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ·mol-1。恒容时, 体系中各物质浓度随时间变化的曲线如图示。下列说法不正确的是( )
2NH3(g) △H=-92.4 kJ·mol-1。恒容时, 体系中各物质浓度随时间变化的曲线如图示。下列说法不正确的是( )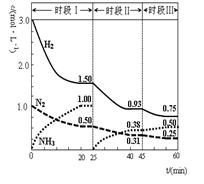
| A.前20分钟反应内放出的热量为46.2kJ |
| B.第25分钟改变的条件是将NH3从反应体系中分离出去 |
| C.若第60分钟时反应又达到了平衡,则时段Ⅲ改变的条件是降低温度 |
| D.时段Ⅰ仅将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com