
| 选项 | 规律 | 推论 |
| A | 含Ag+离子的溶液中滴加氯化钡溶液会产生白色沉淀 | 滴加氯化钡溶液产生白色沉淀的溶液中不一定含有Ag+离子 |
| B | 常温下铜与浓硝酸可以制取NO2 | 常温下铁与浓硝酸也可以制取NO2 |
| C | Fe(OH)3固体中滴加稀盐酸生成氯化铁和水 | Fe(OH)3固体中滴加氢碘酸生成碘化铁和水 |
| D | 铜片不溶于稀硫酸 | 铜片也不溶于稀硝酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.与氯化钡反应生成的白色沉淀可能为硫酸钡、碳酸钡等,不一定为氯化银;
B.常温下铁与浓硝酸发生钝化反应;
C.铁离子具有氧化性,能够将碘离子氧化成碘单质,不会生成碘化铁;
D.铜活泼性较弱,不与稀硫酸反应,由于稀硝酸具有强氧化性,则铜与稀硝酸反应生成硝酸铜、NO气体和水.
解答 解:A.含Ag+离子的溶液中滴加氯化钡溶液会产生白色沉淀AgCl,但是滴加氯化钡溶液产生的白色沉淀可能为硫酸钡、碳酸钡等,溶液中不一定含有Ag+离子,故A正确;
B.常温下铜与浓硝酸可以制取NO2,但常温下铁与浓硝酸发生钝化现象,二者不会反应获得NO2,故B错误;
C.Fe(OH)3固体中滴加稀盐酸会生成氯化铁和水,但Fe(OH)3固体中滴加氢碘酸的反应为:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O,生成的是碘化亚铁,不会生成碘化铁,故C错误;
D.铜不与稀硫酸反应,但是稀硝酸具有强氧化性,则铜能够与稀硝酸发生氧化还原反应,导致铜可溶于稀硝酸,故D错误;
故选A.
点评 本题考查探究化学规律,题目难度中等,明确常见物质的性质为解答关键,C为易错点,注意铁离子具有强氧化性,试题侧重考查学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 核外电子质量很小,在原子核外绕核作高速运动 | |
| B. | 核外电子的运动规律与普通物体不同,不能用牛顿运动定律来解释 | |
| C. | 在电子云示意图中,通常用小黑点来表示电子绕核作高速圆周运动 | |
| D. | 在电子云示意图中,小黑点越密表示电子在核外空间单位体积内电子出现的概率越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铁中滴加稀盐酸溶解:FeO+2H+═Fe2++H2O | |
| B. | 用稀硫酸、双氧水除去FeCl3溶液中的FeCl2杂质:Fe2++2H++H2O2═Fe3++2H2O | |
| C. | 硫酸铝溶液中滴加氨水制取氢氧化铝:Al3++3OH-═Al(OH)3↓ | |
| D. | 向NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+2OH-+Ca2+═2H2O+CaCO3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  制取并收集干燥纯净的NH3 制取并收集干燥纯净的NH3 | B. |  除去NO2中的NO 除去NO2中的NO | ||
| C. |  检验装置的气密性 检验装置的气密性 | D. |  实验室洗涤胶头滴管的操作 实验室洗涤胶头滴管的操作 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  海水防止铁被腐蚀 | |
| B. |  CuSO4精铜的精炼 | |
| C. |  ZnCl2溶液铁片镀锌 | |
| D. |  饱和食盐水验证NaCl溶液(含酚酞)电解产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铊的相关信息卡片如图所示:
铊的相关信息卡片如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;D若为纯净物,D的核磁共振氢谱存在2种吸收峰,面积比为1:1;
;D若为纯净物,D的核磁共振氢谱存在2种吸收峰,面积比为1:1; ,反应类型:消去反应;
,反应类型:消去反应;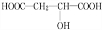 +HCOOH$?_{△}^{浓硫酸}$
+HCOOH$?_{△}^{浓硫酸}$ +H2O,反应类型:取代反应;
+H2O,反应类型:取代反应; ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com