已知一氧化碳与水蒸气的反应为:CO(g)+H
2O(g)?CO
2(g)+H
2(g)
(1)T℃时,在一定体积的容器中,通入一定量的CO(g)和H
2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表:
| 时间/min |
CO |
H2O(g) |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
0.100 |
0.200 |
0.100 |
0.100 |
| 4 |
0.100 |
0.200 |
0.100 |
0.100 |
| 5 |
0.116 |
0.216 |
0.084 |
C1 |
| 6 |
0.096 |
0.266 |
0.104 |
C2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的.则第4~5min之间,改变的条件是
增大氢气浓度
增大氢气浓度
,第5~6min之间,改变的条件是
增大水浓度
增大水浓度
.T℃时该化学反应的平衡常数是
0.5
0.5
.
(2)已知420℃时,该化学反应的平衡常数为9.如果反应开始时,CO和H
2O(g)的浓度都是0.01mol/L,则CO在此条件下的转化率为
75%
75%
.
(3)从420℃升温至800℃,800℃的平衡常数K
2=1,则正反应为
放热反应
放热反应
(填“放热反应”或“吸热反应”或“不能确定”).



 名校课堂系列答案
名校课堂系列答案 煤炭可以转化为清洁能源和化工原料.
煤炭可以转化为清洁能源和化工原料.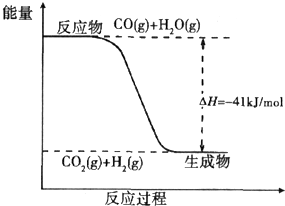 煤炭可以转化为清洁能源和化工原料.
煤炭可以转化为清洁能源和化工原料. CO2(g)+H2(g)
CO2(g)+H2(g)