
【题目】已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Ksp(CaF2)=1.5×10-10
②25℃时,2.0×10-3mol/L氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如图1所示:


(1)下列有关氢氟酸性质中可以证明它是弱电解质的是________________
A. 常温下0.1mol/L的氢氟酸溶液pH约为2
B. 氢氟酸溶液能使紫色石蕊溶液变红
C. 10mL 1mol/L 氢氟酸恰好与10mL 1mol/L NaOH溶液完全反应
D. 某氢氟酸溶液与金属镁反应的速率比较慢
E. 相同条件下氢氟酸溶液的导电能力比盐酸的弱
(2)NaF是一种农业杀虫剂,溶液中四种离子浓度大小关系为___________________
(3)25℃时,将20mL 0.10 mol/L CH3COOH溶液和20mL 0.10 mol/LHSCN溶液分别与20mL 0.10 mol/LNaHCO3溶液混合,分别得到溶液1和溶液2,实验测产生的气体体积(V)随时间(t)变化如图2所示,曲线a反映的是________________(填“CH3COOH”或“HSCN”)与NaHCO3反映产生气体的变化情况,反应结束后所得两溶液中,c(OH-)溶液1_______c(OH-)溶液2 (填“>”、“<”或“=”)
(4)CaF2俗名萤石,难溶于水,若将4.0×10-3mol/L HF溶液与2.0×10-4mol/L CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),判断此时溶液中是否有CaF2沉淀生成并说明理由______
【答案】AE c(Na+)>c(F-)>c(OH-)>c(H+) CH3COOH > 有,Qc= c2(F-)·c(Ca2+)>Ksp(CaF2)
【解析】
(1)A. 常温下0.1mol/L的氢氟酸溶液pH约为2,即溶液中c(H+)=0.01mol/L,远小于氢氟酸的浓度,说明氢氟酸没有完全电离,属于弱酸;
B. 不论强酸还是弱酸溶液都能使紫色石蕊(酸碱指示剂)溶液变红,不能说明是弱酸;
C. 10mL 1mol/L 氢氟酸中氢离子的总物质的量为0.01mol, 10mL 1mol/L NaOH溶液中氢氧根离子总物质的量为0.01mol,恰好完全反应,不能说明氢氟酸是弱酸;
D. 反应速率慢可能是因为氢离子浓度太小,不能说明氢氟酸是部分电离的;
E. 溶液的导电能力与溶液中离子浓度大小及离子所带电荷多少有关,相同条件下的氢氟酸和盐酸溶液的浓度相同,氢氟酸的导电能力差,说明氢氟酸电离出的离子浓度小,说明氢氟酸是弱酸;
(2)NaF溶液中含有Na+、F-、OH-、H+,NaF是强碱弱酸盐,溶液显碱性,则c(OH-)> c(H+),且c(OH-)和 c(H+)来自水的电离,由于F-为弱酸根会水解, F-浓度减小,故c(F-)> c(Na+);
(3)根据已知条件,Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13,则相同条件下,HSCN的酸性强于CH3COOH;等体积,等浓度时,HSCN溶液中的c(H+)比CH3COOH溶液中的大,则反应速率要快,则曲线b为HSCN的反应,曲线a为CH3COOH的反应,最终均与NaHCO3完全反应,得到溶液1(CH3COONa溶液)和溶液2(NaSCN溶液),酸性越弱,水解程度越大,溶液碱性越强,则c(OH-)溶液1> c(OH-)溶液2,
(4)查图,当pH为4.0时,溶液中的c(F-)=1.6×10-3mol/L,溶液中c(Ca2+)=2.0×10-4mol/L ,Qc= c2(F-) c(Ca2+)=5.2×10-10> Ksp(CaF2)=1.5×10-10,有沉淀产生;
(1)A. 常温下0.1mol/L的氢氟酸溶液pH约为2,即溶液中c(H+)=0.01mol/L,远小于氢氟酸的浓度,说明氢氟酸没有完全电离,属于弱酸,故A符合题意;
B. 不论强酸还是弱酸溶液都能使紫色石蕊(酸碱指示剂)溶液变红,不能说明是弱酸,故B不符合题意;
C. 10mL 1mol/L 氢氟酸中氢离子的总物质的量为0.01mol, 10mL 1mol/L NaOH溶液中氢氧根离子总物质的量为0.01mol,恰好完全反应,不能说明氢氟酸部分电离,故C错误;
D. 反应速率慢可能是因为氢离子浓度太小,不能说明氢氟酸是部分电离的,故D不符合题意;
E. 溶液的导电能力与溶液中离子浓度大小及离子所带电荷多少有关,相同条件下的氢氟酸和盐酸溶液的浓度相同,氢氟酸的导电能力差,说明氢氟酸电离出的离子浓度小,说明氢氟酸是弱酸,故E符合题意;
故答案选AE;
(2)NaF溶液中含有Na+、F-、OH-、H+,NaF是强碱弱酸盐,溶液显碱性,则c(OH-)> c(H+),且c(OH-)和 c(H+)来自水的电离,由于F-为弱酸根会水解, F-浓度减小,故c(F-)> c(Na+),溶液中四种离子浓度大小关系为c(Na+)>c(F-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(F-)>c(OH-)>c(H+);
(3)根据已知条件,Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13,则相同条件下,HSCN的酸性强于CH3COOH,等体积。等浓度时,HSCN溶液中的c(H+)比CH3COOH溶液中的大,则反应速率要快,则曲线b为HSCN的反应,曲线a为CH3COOH,最终均与NaHCO3完全反应,得到溶液1(CH3COONa溶液)和溶液2(NaSCN溶液),酸性越弱水解程度越大,溶液碱性越强,则c(OH-)溶液1> c(OH-)溶液2,
故答案为:CH3COOH;>;
(4)查图,当pH为4.0时,溶液中的c(F-)=1.6×10-3mol/L,2.0×10-4mol/L CaCl2溶液中c(Ca2+)=2.0×10-4mol/L ,Qc= c2(F-) c(Ca2+)=5.2×10-10> Ksp(CaF2)=1.5×10-10,有沉淀产生,
故答案为:有,Qc= c2(F-)·c(Ca2+)>Ksp(CaF2)。


科目:高中化学 来源: 题型:
【题目】有下列物质的溶液①CH3COOH ②HCl ③H2SO4 ④NaHSO4
(1)若四种溶液的物质的量浓度相同,其c(H+)的大小顺序为______(用序号表示,下同)。
(2)若四种溶液的c(H+)相同,其物质的量浓度的大小顺序为________。
(3)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为________,经测定溶液中c(CH3COO-)为1.4×10-3 mol·L-1,此温度下醋酸的电离常数Ka=________,温度升高,Ka将______(填“变大”、“不变”或“变小”,下同),加入少量CH3COONa后c(H+) _________,Ka________,原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。设起始
CO(g)+3H2(g)。设起始![]() =Z,在恒压下,平衡时
=Z,在恒压下,平衡时![]() (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
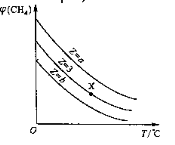
A.该反应的焓变ΔH<0
B.图中Z的大小为b>3>a
C.图中X点对应的平衡混合物中![]() =3
=3
D.温度不变时,图中X点对应的平衡在加压后![]() (CH4)减小
(CH4)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电-Fenton法是用于水体中有机污染物降解的高级氧化技术,反应原理如图所示。电解产生的H2O2与Fe2+发生反应生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法错误的是

A.电源的A极为负极
B.与电源B极相连电极的电极反应式为H2O-e- =H++·OH
C.Fenton反应为:H2O2+Fe2+=Fe(OH)2++·OH
D.每消耗2.24LO2(标准状况),整个电解池中理论上可产生的·OH为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应①![]()
![]()
②![]()
![]()
在不同温度时![]() 、
、![]() 的值如表:
的值如表:
温度 |
|
|
973 |
|
|
1173 |
|
|
据此可知反应③:“![]()
![]() ”的相关信息正确的是( )
”的相关信息正确的是( )
A.![]()
B.该反应正反应为吸热反应
C.该反应进行时不断分离出![]() ,可以提高
,可以提高![]() 的转化率和反应速率
的转化率和反应速率
D.在恒温且容积可变的容器中发生反应③,压缩体积反应速率会增大,![]() 也增大
也增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组在实验室对酸碱中和反应进行探究
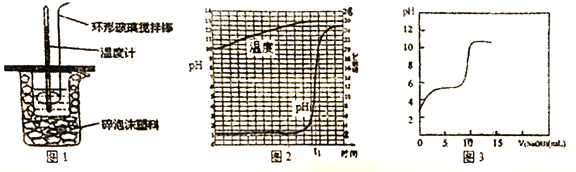
(1)中和热的测定:用50mL 0.5mol/L 的盐酸与50mL 0.55mol/L 的NaOH溶液在如图1所示装置中进行中和热测定,若用等体积等浓度的醋酸代替盐酸,测得中和热数值____。(填“偏大”、“偏小”或“无影响”)
(2)中和滴定:取一定量的稀盐酸,逐滴滴加NaOH溶液,边滴加边振荡。
①指示剂法:用___________(填仪器名称)取一定体积的稀盐酸于锥形瓶中,滴加几滴甲基橙作指示剂,滴定达到终点的现象为__________。
②传感器法:用传感器实时获得溶液的pH、温度曲线如图2所示,当反应达到终点时,溶液的温度为____℃。若用等浓度的醋酸代替稀盐酸,用传感器实时获得溶液的pH如图3所示,图2与图3中溶液起始pH后者较大的原因是__________,图3中反应终点时溶液pH约为8,请用离子方程式表示其原因________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)12g碳与适量水蒸气反应生成CO和H2,需吸收131.3KJ热量,此反应的热化学方程式为______________________________。
(2)已知以下的热化学反应方程式:
①2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ/mol
则:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=______。
(3)已知H2(g)+Br2(l)=2HBr(g) △H=-102kJ/mol,其他的相关数据如下表:
H2(g) | Br2(l) | HBr(g) | |
1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
则表中a为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CH4(g)+2O2(g)→CO2(g)+2H2O(g) ΔH== - Q1 ;
2H2(g)+O2(g) →2H2O(g) ΔH== - Q2;
H2O(g) →H2O(l) ΔH== - Q3
常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为
A.4Q1+0.5Q2B.4Q1+Q2+10Q3C.4Q1+2Q2D.4Q1+0.5Q2+9Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4超干重整CO2技术可得到富含CO的化工原料。回答下列问题:
(1)CH4超干重整CO2的催化转化如图所示:

①已知相关反应的能量变化如图所示:

过程Ⅰ的热化学方程式为________。
②关于上述过程Ⅱ的说法不正确的是________(填序号)。
a.实现了含碳物质与含氢物质的分离
b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应
d.Fe3O4、CaO为催化剂,降低了反应的ΔH
③其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应CH4(g)+CO2(g)=2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点所代表的状态________(填“是”或“不是”)平衡状态;b点CH4的转化率高于c点,原因是________。
(2)在一刚性密闭容器中,CH4和CO2的分压分别为20kPa、25kPa,加入Ni/α-Al2O3催化剂并加热至1123K使其发生反应CH4(g)+CO2(g)=2CO(g)+2H2(g)。

①研究表明CO的生成速率υ(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,某时刻测得p(CO)=20kPa,则p(CO2)=________kPa,υ(CO)=________mol·g-1·s-1。
②达到平衡后测得体系压强是起始时的1.8倍,则该反应的平衡常数的计算式为Kp=________(kPa)2。(用各物质的分压代替物质的量浓度计算)
(3)CH4超干重整CO2得到的CO经偶联反应可制得草酸(H2C2O4)。常温下,向某浓度的草酸溶液中加入一定浓度的NaOH溶液,所得溶液中![]() ,则此时溶液的pH=________。(已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)
,则此时溶液的pH=________。(已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com