
| 5.6L |
| 22.4L/mol |
| 3 |
| 2 |
|
|
| 0.5mol |
| 0.1L |
| 27g/mol×0.1mol |
| 5.1g |


科目:高中化学 来源: 题型:
| 颜色 | Ksp | |
| AgCl | 白色 | 1.8×10-10 mol2?L-2 |
| AgBr | 浅黄色 | 5.0×10-13 mol2?L-2 |
| AgI | 黄色 | 8.3×10-17 mol2?L-2 |
| Ag2CrO4 | 砖红色 | 1.1×10-12 mol3?L-3 |
| HgS | 黑色 | 1.6X10-52 mol2?L-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图1装置模拟铁的吸氧腐蚀 |
| B、图2装置制取并吸收NH3 |
| C、图3装置量取8.5mL的稀硫酸 |
| D、图4装置制取少量乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | HX | HY | HZ | ||
| 浓度mol/L | 0.1 | 0.5 | 0.9 | 1 | 1 |
| 电离度% | 0.3 | 0.15 | 0.1 | 0.3 | 10 |
| A、HX>HY>HZ |
| B、HZ>HX>HY |
| C、HY>HZ>HX |
| D、HZ>HY>HX |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 |
实验目的 | 温度/℃ | 催化剂 质量/g |
反应物初始浓度 /10-3mol?L-1 | |
| H2 | I2 | ||||
| Ⅰ | 为以下两个实验作参照 | 457 | 0 | 7 | 9 |
| Ⅱ | 420 | 0 | 7 | 9 | |
| Ⅲ | 探究催化剂对该反应速率的影响 | 10 | 7 | 9 | |
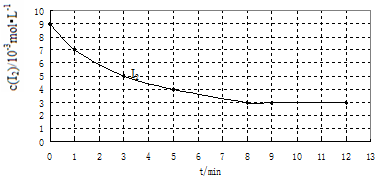
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室标准NaOH溶液对其进行滴定以测定它的准确浓度,完全反应时所得溶液pH大致为9.下表是4种常见指示剂的变色范围:
某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室标准NaOH溶液对其进行滴定以测定它的准确浓度,完全反应时所得溶液pH大致为9.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 图中A为淡黄色固体,B、C为液体,D为气体,E、F为白色沉淀.
图中A为淡黄色固体,B、C为液体,D为气体,E、F为白色沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某些馆的外壳使用非晶硅薄膜,以充分利用太阳能 |
| B、世博会期间,利用可降解的“玉米翅料”替代一次性饭盒,可防止产生白色污染 |
| C、世博会中国馆--“东方之冠”使用的钢筋混凝土属于高分子化合物 |
| D、世博停车场安装催化光解设施,可将汽车尾气中的CO和NOx转化为无毒气体CO2和N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 单质X2、Y和化合物Z的组成元素均为周期表中前20号元素,表格和图分别是X2、Y 和Z的有关信息以及他们之间的转化关系 (其他无关物质已略去).请回答下列问题:
单质X2、Y和化合物Z的组成元素均为周期表中前20号元素,表格和图分别是X2、Y 和Z的有关信息以及他们之间的转化关系 (其他无关物质已略去).请回答下列问题:| 元素X | 易形成-1价18电子的单核离子 |
| 元素Y | 第3周期第ⅥA族 |
| 化合物Z | 所含阳离子有3个电子层 |
| 常温下0.1mol?L-1Z的水溶液pH=13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com