
| A | B | C | D | |
| 实验方案 | 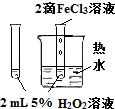 |
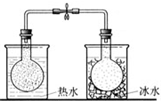 将NO2球浸泡在冰水和热水中 |
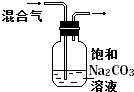 |
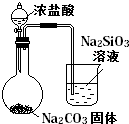 |
| 实验 目的 |
验证FeCl3对H2O2分解反应有催化作用 | 探究温度对平衡 2NO2?N2O4的影响 |
除去CO2气体中混有的SO2 | 比较HCl、H2CO3和H2SiO3的酸性强弱 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
 如图是一个盐桥中充满饱和KCl溶液的锌铜原电池装置,下列分析正确的是( )
如图是一个盐桥中充满饱和KCl溶液的锌铜原电池装置,下列分析正确的是( )| A、Cu片上发生氧化反应 |
| B、电子由Cu片经外电路流向Zn片 |
| C、盐桥中的Cl-移向ZnSO4溶液 |
| D、一段时间后烧杯中c(Zn2+)、c(Cu2+)均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、W的氧化物是原子晶体 |
| B、Q的简单氢化物分子构型为三角锥形 |
| C、Y元素的核外电子中,只有1个未成对电子 |
| D、X的氢化物的沸点>Q的氢化物的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水的浓度大于盐酸的浓度 |
| B、原氨水中有1%的含氮微粒为NH4+ |
| C、氨水中水电离出的c(H+)是盐酸中水电离出的c(H+)的100倍 |
| D、混合溶液中c(NH4+)+c(NH3?H2O)+c(NH3)=5×10-4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
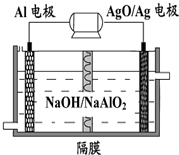 铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.
铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.| A、该隔膜是阳离子交换膜 |
| B、正极的电极反应式为:O2+2H2O+4e-=4OH- |
| C、Al电极的反应式为:Al-3e-+4OH-=AlO2-+2H2O |
| D、当电极上析出0.54 g Ag时,电路中转移的电子为0.005mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com