
下列物质提纯的方法正确的是
A.除去混在NO2中的NO:将气体与足量O2混合
B.除去混在CO2中的SO2:将气体依次通过足量酸性KMnO4溶液和浓硫酸
C.除去KCl溶液中的K2CO3:加入过量BaCl2溶液后过滤
D.除去乙酸中混有的乙醇:加入生石灰后蒸馏
科目:高中化学 来源: 题型:阅读理解

 阴极获得钛可能发生的反应或电极反应为:
阴极获得钛可能发生的反应或电极反应为: ,下列说法正确的是
,下列说法正确的是查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下钛的化学活性很小,在较高温度下可与多种物质反应.
常温下钛的化学活性很小,在较高温度下可与多种物质反应.
| >400℃ | 约1250℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 灼烧 |
| 浸泡 |
| 过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
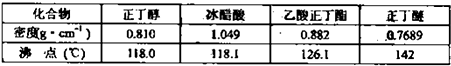
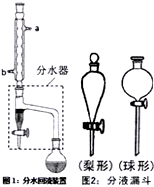 实验室制备乙酸正丁酯的化学方程式:
实验室制备乙酸正丁酯的化学方程式:| 浓H2SO4 |
| △ |
| 浓H2SO4 |
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com