
| 元素 | 结构或性质信息 |
| T | 基态原子的L层上s电子数等于p电子数 |
| X | 基态原子最外层未成对电子数在该元素所在周期中最多 |
| Y | 基态原子的第一电离能在该元素所在周期中最小 |
| Z | 单质常温、常压下是气体。基态原子的M层上有1个未成对的p电子 |
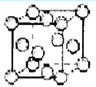

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源:不详 题型:填空题
| 元素 | a | b | c | d | e | f | g |
| 最外层电子数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
查看答案和解析>>
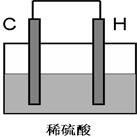
科目:高中化学 来源:不详 题型:实验题
| | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | A | | | | | | | |
| 二 | B | | | C | D | E | F | |
| 三 | G | | H | | | | I | J |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | | | | ① | ② | ③ | | |
| 3 | ④ | | ⑤ | ⑥ | | ⑦ | ⑧ | ⑨ |
| 4 | ⑩ | | | | | | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 乙+丙 B 乙
乙+丙 B 乙 氧化物+H2O
氧化物+H2O 丙。则:
丙。则:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
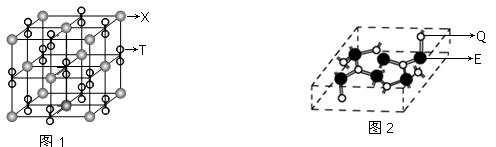
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NaH)。生成物氢化钠的电子式为________,含有的化学键为_____键(填“离子”、“共价”或“金属”)。
2NaH)。生成物氢化钠的电子式为________,含有的化学键为_____键(填“离子”、“共价”或“金属”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com