
| A. | 1.1mol | B. | 1.5mol | C. | 1.2mol | D. | 1.0mol |
分析 还原性强弱:I->Fe2+,氯气先氧化碘离子,再氧化亚铁离子,已知氯气的物质的量为0.15mol,发生反应离子方程式为:Cl2+2I-=2Cl-+I2,碘离子完全氧化后,溶液中有$\frac{1}{2}$的Fe2+被氧化成Fe3+,发生反应离子方程式为:
Cl2+2Fe2+=2Cl-+Fe3+,设原碘化亚铁溶液的物质的量浓度为cmol/L,则c(I-)=2c(FeI2)=2c,c(Fe2+)=cmol/L,
所以与碘离子反应消耗的氯气为n(Cl2)=$\frac{1}{2}$n(I-)=$\frac{1}{2}$cV=0.1cmol,
反应完成后溶液中有$\frac{1}{2}$的Fe2+被氧化成Fe3+,则与亚铁离子反应消耗的氯气为n(Cl2)=$\frac{1}{2}$×$\frac{1}{2}$n(Fe2+)=$\frac{1}{4}$cV=0.025cmol,据此计算原碘化亚铁溶液的物质的量.
解答 解:已知:还原性强弱:I->Fe2+,往碘化亚铁溶液中缓慢通入1.5mol氯气,氯气先氧化碘离子,再氧化亚铁离子,已知氯气的物质的量为0.15mol,发生反应离子方程式为:Cl2+2I-=2Cl-+I2,碘离子完全氧化后,溶液中有$\frac{1}{2}$的Fe2+被氧化成Fe3+,发生反应离子方程式为:
Cl2+2Fe2+=2Cl-+Fe3+,设原碘化亚铁溶液的物质的量浓度为cmol/L,则c(I-)=2c(FeI2)=2c,c(Fe2+)=cmol/L,
所以与碘离子反应消耗的氯气为n(Cl2)=$\frac{1}{2}$n(I-)=$\frac{1}{2}$cV=0.1cmol,
反应完成后溶液中有$\frac{1}{2}$的Fe2+被氧化成Fe3+,则与亚铁离子反应消耗的氯气为n(Cl2)=$\frac{1}{2}$×$\frac{1}{2}$n(Fe2+)=$\frac{1}{4}$cV=0.025cmol,所以0.025cmol+0.1cmol=0.15mol
解得:c=1.2mol/L,
故选C.
点评 本题主要考查学生氧化还原反应的有关计算,为高频考点,侧重于学生的分析能力和计算能力来的考查,注意溶液中离子反应的顺序,根据离子方程式计算,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,NA个水分子所占的体积约为22.4L | |
| B. | 5.6g铁与氯气完全反应,失去电子的数目为0.2NA | |
| C. | 1 mol Na2O2与足量CO2充分反应,转移的电子数为2NA | |
| D. | 在标准状况下,22.4L由N2、N2O组成的混合气体中所含的氮原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| C. | “玉不琢不成器”,“百炼方能成钢”发生的均为化学变化 | |
| D. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
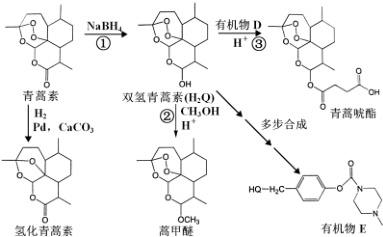
 .
. 外,还需含苯环的二羟基化合物F,写如有机物F与NaOH 溶液反应的离子反应方程式
外,还需含苯环的二羟基化合物F,写如有机物F与NaOH 溶液反应的离子反应方程式 ,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有 4 种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.
,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有 4 种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
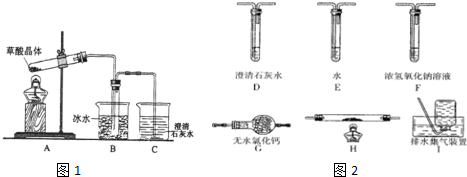
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2→SO3:2SO2+O2═2SO3 | |
| B. | Fe→Fe2+:Fe+2H+═Fe2++H2↑ | |
| C. | Cl-→Cl2:2Cl-+I2═Cl2+2I- | |
| D. | Cu→Cu(NO3)2:3Cu+8HNO3(浓)═Cu(NO3)2+NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加高工厂烟囱,使烟尘和废气远离地表 | |
| B. | 推广使用燃煤脱硫技术,防止SO2污染 | |
| C. | 研制新型高效可充电电池,发展电动汽车 | |
| D. | 开发利用绿色能源,替代化石燃料 |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:填空题
FeCO3与砂糖混用可作补血剂。以黄铁矿烧渣(含CuO、Fe2O3、FeO、SiO2、Al2O3等)为主要原料制备FeCO3的流程如下:
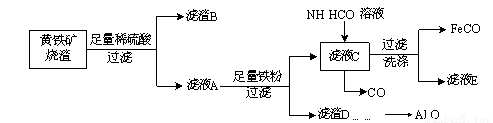
(1)质量分数为30%(密度是1.176 g·cm-3)的稀硫酸的物质的量浓度为 。
(2)检验滤液A中存在Fe2+的试剂是 。
(3)加入足量铁粉的作用除调节pH使Al3+转化为Al(OH)3沉淀外,还有两个作用,写出其中一个反应的离子方程式: 。
(4)写出滤液C与NH4HCO3溶液反应的离子方程式: 。
(5)FeCO3在空气中灼烧可制得铁系氧化物材料。已知25℃,101 kPa时:
4Fe(s)+3O2(g) 2Fe2O3 ΔH=﹣1648 kJ·mol-1
2Fe2O3 ΔH=﹣1648 kJ·mol-1
C(s)+O2(g) CO2(g) ΔH=﹣393 kJ·mol-1
CO2(g) ΔH=﹣393 kJ·mol-1
2Fe(s)+2C(s)+3O2(g) 2FeCO3(s) ΔH=﹣1480 kJ·mol-1
2FeCO3(s) ΔH=﹣1480 kJ·mol-1
写出FeCO3在空气中灼烧生成Fe2O3的热化学方程式: 。
(6)某兴趣小组为充分利用副产品,欲利用滤渣D为原料制取Al2O3,请补充完成实验步骤:向滤渣D中加入适量NaOH溶液, 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com