
(9分)一种常用融雪剂的主要成分的化学式为XY2,X原子的结构示意图为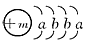 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m=________,该融雪剂的化学式为________。
(2)W元素的名称为________,H2Z的结构式是______ __。
(3)下列说法正确的是________。
A.XY2和WZ2都为离子化合物 B.XY2中仅含离子键,WZ2中仅含共价键
C.H2Z比HY的稳定性强 D.X的阳离子比Y的阴离子半径大
(4)Y元素的单质与H2Z水溶液反应会将Z单质置换出来,请写出该反应的化学方程式 ,氧化性比较:Z Y2(填“>”或“<”)。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年北京市延庆县高三3月模拟理综化学试卷(解析版) 题型:实验题
(15分)焦亚硫酸钠(Na2S2O5)是一种常用的抗氧化剂。
某研究小组对焦亚硫酸钠进行如下研究:
(1)采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。
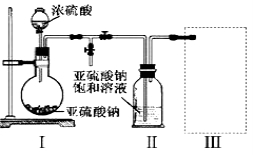
装置Ⅱ中有Na2S2O5析出,发生的化学反应方程式为:Na2SO3 + SO2 = Na2S2O5。
①装置Ⅰ中产生气体的化学方程式为 。
②要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 。
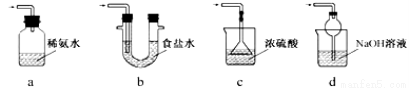
③装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为 (填序号)。
(2)【查阅资料】Na2S2O5溶于水即生成NaHSO3。
①NaHSO3溶液显酸性。请用化学用语和必要的文字解释原因________________________________;
证明该结论可采用的实验方法是 (填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
②检验Na2S2O5晶体在空气中已被氧化的实验方案是__________________。
(3)焦亚硫酸钠(Na2S2O5)在酸性条件下可将工业废水中的Cr2O72—还原为Cr3+。
①写出该反应的离子方程式_______________________。
②若处理Cr2O72—浓度为1×10-3mol/L的工业废水1L,需用Na2S2O5固体_________mg。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省台州市高三3月调研考试理综化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W、M的原子序数依次增大,X、Z同主族,Z、W、M同周期,其中X 与Y能形成两种物质,且常温下均为液体。W的氧化物既能溶于强碱溶液,又能溶于X、M形成的水溶液。已知W与M形成的物质在178°C时升华。下列说法不正确的是
A.Z、W、M的原子半径由大到小的顺序为Z>W>M
B.M分别与Z、W所形成的物质的晶体类型相同
C.X2Y2易溶于X2Y中,是由于X2Y2与X2Y能形成分子间氢键
D.将Z2Y在空气中加热可得到Z2Y2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省韶关市高三调研考试理综化学试卷(解析版) 题型:填空题
(15分)镁橄榄石主要成分是Mg2SiO4,电解法促进镁橄榄石固定CO2的工艺流程如下图所示:
已知:Mg2SiO4(s)+4HCl(aq) 2MgCl2(aq)+SiO2(s)+2H2O(l) △H =-49.04 kJ·mol-1
2MgCl2(aq)+SiO2(s)+2H2O(l) △H =-49.04 kJ·mol-1
固碳时主要反应的方程式为NaOH(aq)+CO2(g)=NaHCO3(aq)。
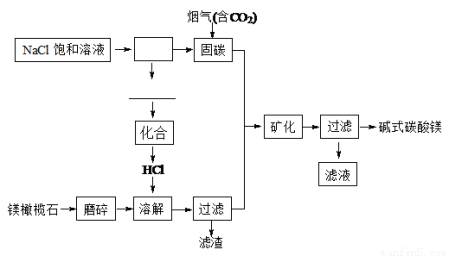
(1)上图方框里的操作名称是 ,横线上的物质有(填化学式) 。
(2)下列物质中也可用作“固碳”的是(填字母序号) 。
A.CaCl2 B.NH3·H2O
C.Na2CO3 D.H2O
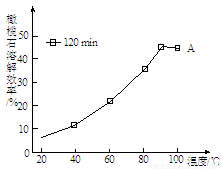
(3)由下图可知,90 ℃后曲线A溶解效率下降,分析其原因 。
(4)经分析,所得碱式碳酸镁沉淀中含有少量NaCl。为提纯,可采取的方法是 。本流程中可循环利用的物质是(填化学式) 。
(5)另一种橄榄石的组成是Mg9FeSi5O20,用氧化物的形式可表示为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省韶关市高三调研考试理综化学试卷(解析版) 题型:选择题
下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol/L H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
B | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出Na2CO3晶体 |
C | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体 | HX放出的氢气多且反应速率快 | HX酸性比HY弱 |
D | 先向2mL0.1mol/LNa2S溶液中滴几滴0.1mol/LZnSO4溶液,再加入几滴0.1mol/LCuSO4溶液 | 开始有白色沉淀生成;后又有黑色沉淀生成 | Ksp(ZnS)<Ksp(CuS) |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高一4月月考理科化学试卷(解析版) 题型:选择题
氮的某种氧化物和一氧化碳在催化剂的作用下充分反应,生成氮气和二氧化碳。若测得氮气和二氧化碳的物质的量之比为1∶2,则这种氮的氧化物是
A、N2O B、NO2 C、NO D、N2O5
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高一4月月考理科化学试卷(解析版) 题型:选择题
YBa2Cu8Ox(Y为钇元素)是磁悬浮列车中的重要超导材料,关于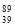 Y的说法正确的是
Y的说法正确的是
A.钇在周期表中的位置是第4周期ⅢB族 B.属于非金属元素
C.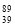 Y和
Y和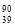 Y是两种不同的核素 D.中子数为39
Y是两种不同的核素 D.中子数为39
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省八校高三二次联考理综化学试卷(解析版) 题型:选择题
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)  Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+ H2O  HClO + H+ +Cl- K2=10-3.4
HClO + H+ +Cl- K2=10-3.4
HClO  H+ + ClO- Ka=?
H+ + ClO- Ka=?
其中,Cl2(aq)、HClO和ClO-分别在三者中所占的物质的量分数(α)随pH变化的关系如图所示。下列表述正确的是
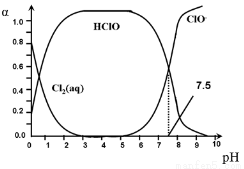
A.Cl2(g)+ H2O  2H+ + ClO- + Cl- K=10-10.9
2H+ + ClO- + Cl- K=10-10.9
B.pH=7.5时,用氯处理饮用水体系中,c(Cl-) + c(HClO) =c(H+)-c(OH-)
C.用氯处理饮用水时,pH=6.5时杀菌效果比pH=4.5时好
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列叙述中,正确的是
A.同周期元素中,ⅦA族元素的原子半径最大
B.ⅥA族元素的原子,其半径越大,越容易得到电子
C.在周期表主族元素的最外层电子数等于其主族序数
D.元素周期表中从ⅢB到ⅡB这10个纵行的元素都是金属元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com